左半结肠癌的手术包括传统腹腔镜结肠切除术(LAC)、手辅助腹腔镜手术(HALS)与开放式结肠切除术。LAC和HALS较开放性手术有更高的短期疗效、更短的恢复时间和更小的手术创伤[1,2]。HALS是一种利用手入腹腔辅助的腹腔镜手术,通过触觉反馈,有利于暴露和钝性剥离,同时限制手术切口的长度为6~8 cm[3]。由于腹腔镜手助,HALS能够解决一些操作难度大的术中情况,因此减少中转为开放手术比例,同时保留了微创手术的特点,以及保留了传统腹腔镜手术的所有特征且不会增加成本[4]。由于左半结肠癌的发病率较低、腹腔镜手术的学习曲线长,本文收集我院近些年收治的左半结肠癌患者的临床资料,通过与传统LAC比较,介绍作者的临床体会。
1 材料与方法
1.1 一般资料
回顾性分析2013年1月~2018年12月在广州市红十字会医院普外科接受腹腔镜辅助或手辅助腹腔镜左半结肠癌手术患者的临床资料,根据病例纳入标准纳入共174例,其中HALS共81例,LAC 93例。所有手术在术前经科室讨论拟定手术方式为HALS或LAC。
病例纳入标准:①所有患者均在术前进行肠镜检查、病理活检及CT检查,明确诊断并定位;②肿瘤的位置包括脾曲、近脾曲、降结肠、乙状结肠上段;③患者无严重的心、肺、肝、肾等重要器官并发症;④患者无合并其他肿瘤病史;⑤充分的术前准备。
1.2 研究方法
1.2.1 分组 将符合病例纳入标准的病例资料按接受的手术方式分为手辅助腹腔镜组(HALS组)和腹腔镜辅助组(LAC组)。其中HALS组共81例。腹腔镜组共93例(包括中转开腹例数)。
1.2.2 观察指标 患者的临床资料参数:主要包括性别、年龄、体质指数(BMI)、合并症、腹部手术史、术前肿瘤分期及高风险手术因素(粘连、梗阻)及腹部手术史。手术相关参数:主要包括手术时间、出血量、中转开腹率、手术切口总长度、淋巴结清扫数目、手术并发症、手术中造成的副损伤、非计划二次手术。术后恢复情况:主要包括术后进食时间、术后肛门排气时间及术后住院时间。
1.3 手术方法
两组均行气管插管全麻,患者头低脚高位,手术野皮肤常规消毒。HALS组以脐为中心作一绕脐切口,长约6 cm,置入蓝碟,耻骨联合上方3 cm、右下腹、左下腹做一小切口,置入腹腔镜及操作钳,术者左手经过蓝碟进入腹腔。LAC组脐下3 cm作1.5 cm纵切口,置1 cm套管,建立气腹。置腹腔镜,右中腹脐上穿刺置1 cm套管一个,左下腹、右上腹各穿刺置一0.5 cm套管作为操作孔。
HALS组手术方法:术者左手经过蓝碟进入腹腔,常规探查腹腔,判断肿瘤的位置、大小、浸润程度、有无多发灶,有无腹膜种植或脏器转移,明确肠系膜根部血管有无肿大的淋巴结。采用中间入路的手术方法,视术中探查情况选择结扎肠系膜下动静脉、结肠中动静脉左支、左结肠动静脉,乙状结肠动静脉分支并清扫相应区域的淋巴结,在此游离过程中在保持外科平面,保护输尿管、脾脏、肠管等。内侧Toldt"s拓展完全,在外侧将乙状结肠第一曲外侧与左侧固有粘连处切开向上游离,切断膈结肠韧带至脾曲,暴露胰尾和脾脏。向上游离左结肠系膜至胰腺前方,切断横结肠系膜左半与胰腺分离。从上方由右向左于弓内切断胃结肠韧带进入胃网膜囊,切断胃脾韧带会师完成游离。在此游离过程中可以根据情况从不同的方向游离。将结肠经蓝碟提出至腹腔外,在直视下清扫系膜根部淋巴组织,切除系膜及肠管,行横结肠乙状结肠吻合。
LAS组手术方法:探查无穿刺损伤,探查腹腔,采用中间入路的手术方法,超声刀分离肠系膜下动静脉,视肿瘤具体位置、探查情况处理相应动静脉和区域淋巴结清扫范围(大致同HALS)。分离乙状结肠、降结肠系膜、胰腺下缘,切断横结肠系膜左侧,切断胃结肠韧带左侧和脾结肠韧带。切断乙状结肠、降结肠外侧腹膜,乙状结肠、降结肠及横结肠左半完全游离(大致同HALS)。解除气腹,拔除脐下套管,穿刺口向上延长约4 cm,保护切口,取出降结肠,切除系膜,切断远肠管,行乙状结肠横结肠端侧吻合。
1.4 统计学处理
所有病例资料的数据采用SPSS 23.0进行分析,计数数据按百分比描述,行卡方检验或Fisher确切概率法;计量数据符合正态分布采用t检验或不合符采用秩和检验。所有检验均采用双侧检验,取α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 临床资料参数的比较结果
HALS组和LAC组在性别、年龄、BMI、合并症、术前肿瘤分期、腹部手术史等临床资料参数的差异无显著的统计学意义,P值均大于0.05。(详见表1)。
2.2 手术学相关指标的比较结果
表1 两组一般临床资料参数比较
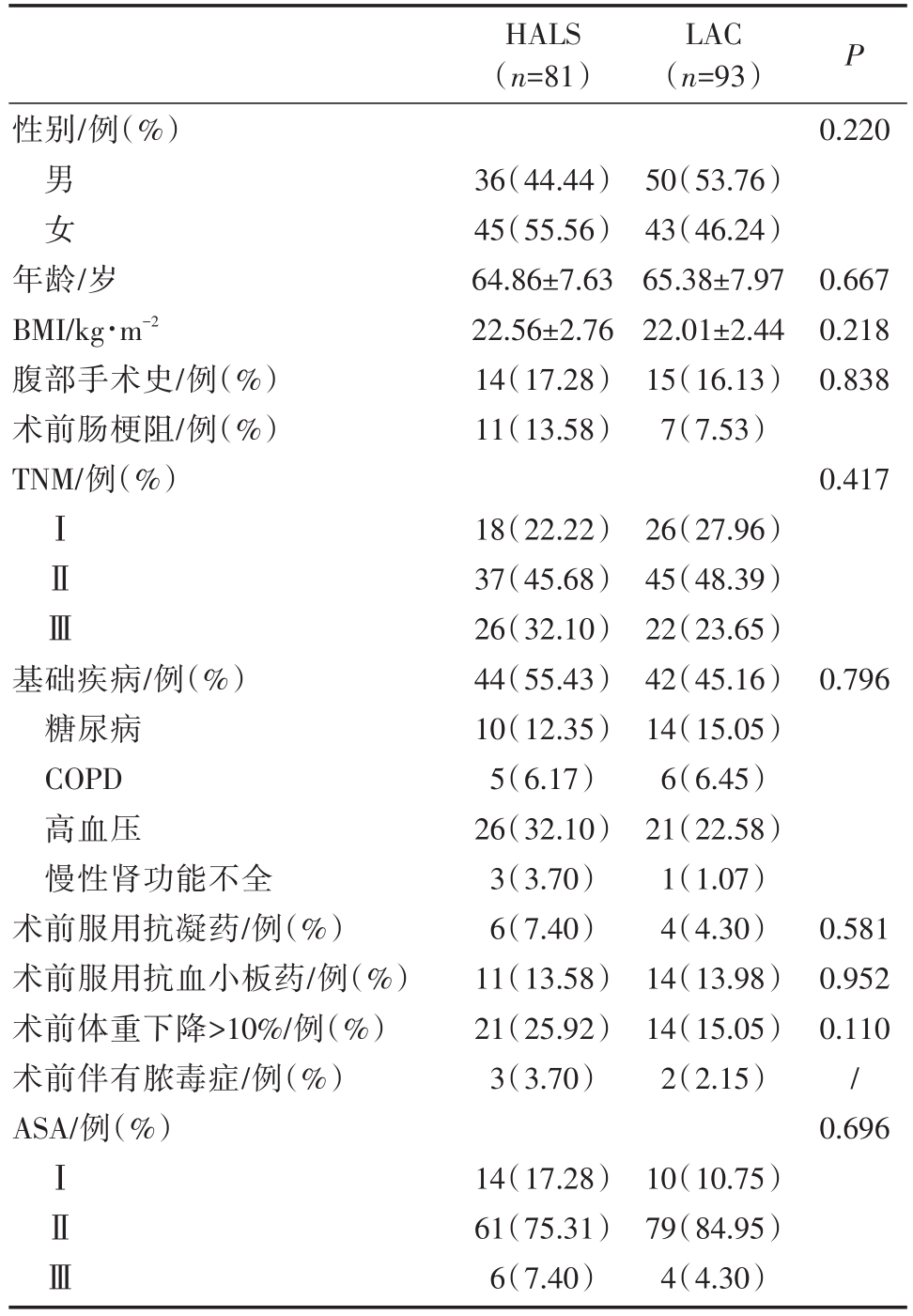
COPD:阻塞性肺病
HALS(n=81)LAC(n=93)P性别/例(%)0.220男女年龄/岁BMI/kg·m-2腹部手术史/例(%)术前肠梗阻/例(%)TNM/例(%)36(44.44)45(55.56)64.86±7.63 22.56±2.76 14(17.28)11(13.58)50(53.76)43(46.24)65.38±7.97 22.01±2.44 15(16.13)7(7.53)0.667 0.218 0.838 0.417ⅠⅡⅢ基础疾病/例(%)糖尿病COPD高血压慢性肾功能不全术前服用抗凝药/例(%)术前服用抗血小板药/例(%)术前体重下降>10%/例(%)术前伴有脓毒症/例(%)ASA/例(%)18(22.22)37(45.68)26(32.10)44(55.43)10(12.35)5(6.17)26(32.10)3(3.70)6(7.40)11(13.58)21(25.92)3(3.70)26(27.96)45(48.39)22(23.65)42(45.16)14(15.05)6(6.45)21(22.58)1(1.07)4(4.30)14(13.98)14(15.05)2(2.15)0.796 0.581 0.952 0.110/0.696ⅠⅡⅢ14(17.28)61(75.31)6(7.40)10(10.75)79(84.95)4(4.30)
本课题收集总病例数为HALS组81例,其中包括中转开腹5例,占6.17%,LAC总病例数为93例,包括中转开腹13例,占13.98%,差异无统计学意义,P=0.092。在进行其他手术学指标相关的比较研究时,已将中转开腹病例排除,HALS组剩余76例,LAC组剩余80例。HALS组与LAC组在手术时间的结果为156.59±18.00 min VS 176.51±14.05 min,两组相比,HALS组的手术时间明显缩短(P<0.001)。术中出血量HALS组为59.83±6.25 mL。LAC组为74.48±9.21 mL,HALS组明显的减少了术中出血量(P=0.035)。HALS组中转手术5例,LAC组为13例,两组比较没有统计学意义(P=0.15),两组在手术切口长度、淋巴结清扫数目的差异无统计学意义,P值均大于0.05。在术后并发症、手术副损伤及术后非计划二次手术率的差异也无统计学意义。(详见表2)。
2.3 术后恢复的临床资料比较结果
HALS组和LAC组在术后住院天数及术后肛门排气时间的比较结果显示LAC在术后胃肠功能的恢复较HALS组慢,差异具有统计学意义。在术后恢复进食的天数两组的差异无显著的统计学意义(P=0.123),见表3。
表2 手术相关指标的比较

P择期手术/例(%)急诊手术/例(%)中转手术/例(%)手术时间/min腹腔粘连/例(%)切口长度/cm淋巴结清扫/个估计失血量/mL外科并发症/例(%)胃麻痹盆腔脓肿肠梗阻切口感染吻合口漏吻合口出血术中腹腔脏器损伤/例(%)输尿管损伤脾脏损伤肠管损伤二次手术/例(%)延期缝合脓肿引流肠切除术肠粘连松解术HALS(n=81)76 5 5 156.59±18.00 11(13.58)8.36±0.48 15.4±4.1 59.8±36.3 5(6.58)1(1.32)0 2(2.63)1(1.32)1(1.32)0 2(2.63)1(1.31)0 1(1.32)3(3.95)1(1.25)0 1(1.25)1(1.25)LAC(n=93)90 3 13 176.51±14.05 7(7.53)8.14±1.46 15.1±3.1 74.5±49.2 6(7.50)0 2(2.50)1(1.25)1(1.25)1(1.25)1(1.25)4(5.00)0 2(2.50)2(2.50)4(5.00)1(1.25)1(1.25)1(1.25)1(1.25)0.573 0.150<0.001 0.263 0.229 0.605 0.035 0.822 0.682 0.944
表3 术后恢复的临床资料比较

P术后进食时间/d术后住院时间/d肛门排气时间/d HALS(n=81)4.99±2.66 8.50±2.79 2.79±1.66 LAC(n=93)4.34±0.99 7.87±2.74 2.50±1.51 0.123 0.161 0.255
3 讨 论
当前的结果显示,HALS手术方式在治疗左半结肠癌根治术方面,短期的临床效果同传统的腹腔镜手术相似,在手术时间、出血量、清扫淋巴结数、手术切口长度、手术副损伤、术后并发症、非计划二次手术方面,HALS组和LAC组间的差异均没有统计学意义(P均大于0.05),虽然HALS术式中转开腹病例数相对少于LAC组,但差异没有统计学意义(P=0.15)。有关HALS和LAC术式比较的报道很多,结果不尽相同,各自研究的结果差异可能归因于外科医生的经验、医院类型、手术适应证选择、患者个体情况、康复方案以及手术部位感染和肠梗阻等术后并发症的定义[5]。本研究结果大部与文献报道一致。
由于两种术式操作有很大不同,但影响两组结果观察因素很多。首先,在本组病例中,观察到HALS和LAP结肠切除术的手术时间有明显差异,这符合之前有报道手辅助结肠切除术具有显著的节省时间优势[6,7]的报道。虽然手术时间缺乏差异的确切原因无法确定,作者认为可能HALS术式在术中操作与外科医生的经验有关,如具有丰富开腹手术的经验,从而导致HALS中操作更有效,经常使用或习惯于开放性技术进行左半结肠根治手术的外科医生可能比以执行腔镜手术为主的外科医生可能更具有开腹内操作的技术和经验。同样的报道两种术式也显示在手术部位感染、肠梗阻发生、吻合口瘘或住院时间方面没有差异[8]。另外,由于一些未知因素,如上述的外科医生的经验、手术的复杂性、麻醉药物使用或术中遇到的肠粘连,也无法进行更准确的评估。与手术方式选择相关的选择偏差也是影响结果的重要因素,HALS左半结肠切除术患者术前风险的增加可能是外科医生于决定采用HALS手术入路而不是LAP术式,甚至术者选择开放入路。
LAC是目前国内外结直肠癌众多手术方式中应用最为广泛的手术方法,HALS恢复了外科医生的手眼协调性,学习曲线短,尤其适用于手术情况相对复杂、发病率较低的左半结肠癌[9,10]。HALS在术中可以快速控制出血,对于术中出现的意外能进行最快的补救,提高了手术的安全性,降低了手术中转开腹率[11],而本组病例中没有显示出两组中转率的差异具有统计学意义,可能与收集的病例数不够有关。HALS的劣势可能与短期病死率高有关[12,13],Benlice等[13]总结 7843 结肠癌根治生存情况,包括LAP组4656例、HALS组3187例,结果LAP组平均手术时间稍长(178±86 vs 171±84 min,P<0.001),HALS组总病死率、切口感染率、肠梗阻发生率均略高于LAP组。但这些研究仅限于一年或两年的数据收集,其限制的因素较多如排除肥胖人群,进行独立判断的价值有限。另外,有报道认为HALS从严格意义上讲不属于腹腔镜手术,认为不应该使用手助来克服腹腔镜学习曲线长的问题,从而减少腹腔镜手术技能的必要的培训和熟练程度的要求[14],以成为避免腔镜的中转手术和缩短手术时间的借口[11]。总之,本研究显示HALS较LAC具有明显的手术时间优势,是左半结肠切除术的一个有价值的术式,安全性高。
参考文献
[1] Lacy AM,García-Valdecasas JC,Delgado S,et al.Laparoscopyassisted colectomy versus open colectomy for treatment of nonmetastatic colon cancer:a randomised trial[J].Lancet,2002,359(9325):2224-2229.
[2] Zhang X,Wu Q,Gu C,et al.Hand-assisted laparoscopic surgery versus conventional open surgery in intraoperative and postoperative outcomes for colorectal cancer:An updated systematic review and meta-analysis[J].Medicine(Baltimore),2017,96(33):e7794.
[3] Tajima T,Mukai M,Noguchi W,et al.Comparison of hand-assisted laparoscopic surgery and conventional laparotomy for rectal cancer:Interim results from a single center.Mol[J].Clin Oncol,3(3):533-538.
[4] Moloo H,Haggar F,Coyle D,et al.Hand assisted laparoscopic surgery versus conventional laparoscopy for colorectal surgery[J].Cochrane Database Syst Rev,2010,(10):CD006585.
[5] Guend H,Lee DY,Myers EA,et al.Technique of last resort:characteristics of patients undergoing open surgery in the laparoscopic era[J].Surg Endosc,2015,29(9):2763-2769.
[6] Nakajima K,Lee SW,Cocilovo C,et al.Laparoscopic total colectomy:hand-assisted vs standard technique[J].Surg Endosc,2004,18(4):582-586.
[7] Marcello PW,Fleshman JW,Milsom JW,et al.Hand-assisted laparoscopic vs.laparoscopic colorectal surgery:a multicenter,prospective,randomized trial[J].Dis Colon Rectum,2008,51(6):818-826.
[8] Pendlimari R,Touzios JG,Azodo IA,et al.Short-term outcomes after elective minimally invasive colectomy for diverticulitis[J].Br J Surg,2011,98(3):431-435.
[9] 王贵玉.手辅助腹腔镜结直肠癌根治术的发展,优势与应用[J].中华结直肠疾病电子杂志,2015,4(1):26-31.
[10] Siddiqui J,Young CJ.Thirteen-year experience with hand-assisted laparoscopic surgery in colorectal patients[J].ANZ J Surg,2020,90(1-2):113-118.
[11] Aalbers AG,Biere SS,van Berge Henegouwen MI,Bemelman WA.Hand-assisted or laparoscopic-assisted approach in colorectal surgery:a systematic review and meta-analysis[J].Surg Endosc,2008,22(8):1769-1780.
[12] Moghadamyeghaneh Z,Carmichael JC,Mills S,et al.Hand-Assisted Laparoscopic Approach in Colon Surgery[J].J Gastrointest Surg,2015,19(11):2045-2053.
[13] Benlice C,Costedio M,Kessler H,et al.Comparison of straight vs hand-assisted laparoscopic colectomy:an assessment from the NSQIP procedure-targeted cohort[J].Am J Surg,2016,212(3):406-412.
[14] Targarona EM,Gracia E,Rodriguez M,et al.Hand-assisted laparoscopic surgery[J].Arch Surg,2003,138(2):133-141.

