甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是最常见的分化型甲状腺癌,其详尽机制尚未阐明。近年认为慢性炎症在肿瘤的发生中起重要作用。在肿瘤微环境中,趋化因子可由肿瘤细胞、免疫细胞和基质细胞分泌,诱导不同的免疫细胞亚群迁移至肿瘤部位,或直接作用于肿瘤细胞和血管内皮细胞,调节肿瘤免疫反应,影响肿瘤细胞的增殖、侵袭和转移。CXC趋化因子配体10(chemokine(C-X-C motif)ligand 10,CXCL10)是非谷氨酸-亮氨酸-精氨酸序列(glutamic acidleueinerginine,ELR)CXC趋化因子的一员,研究显示与慢性炎症、自身免疫性疾病和肿瘤等多种疾病相关[1],其与PTC的发生和进展的相关性仍待探讨。本研究旨在通过检测CXCL10在PTC组织及良性甲状腺疾病甲状腺组织中的表达,探讨CXCL10表达水平与PTC患病及侵袭转移风险的相关性。
1 材料与方法
1.1 研究对象
2008年1月至2013年3月于中山大学孙逸仙纪念医院行首次甲状腺手术,术后病理确诊为甲状腺乳头状癌者105例。入组标准为:2008年1月至2013年3月于本院行首次甲状腺手术,术后病理确诊为PTC。排除标准为:①临床资料缺失;②超声资料缺失;③无法进行TNM分期及AJCC分期者;④合并其他免疫性疾病者;⑤合并其他恶性肿瘤者;⑥合并其他严重疾病者;⑦石蜡切片缺失者。甲状腺良性疾病结节性甲状腺肿(nodular goiter,NG)和慢性淋巴细胞性甲状腺炎(chronic lymphocytic thyroiditis,CLT)各20例。本研究已获得所有患者的书面知情同意和孙逸仙纪念医院伦理委员会的批准。
1.2 资料收集
收集上述PTC、NG、CLT患者的临床和病理资料。临床资料包括年龄、性别、术前超声资料,病理资料包括病理诊断、TNM分期、AJCC分期。其中术前超声资料包括病灶数量、大小,边缘、形状、回声、实质性、均质性、内部钙化、血流和颈部淋巴结大小、形状、皮髓质分界,囊实性、钙化。病理诊断由有经验的病理医生根据世界卫生组织甲状腺恶性肿瘤分类进行独立判定。TNM及AJCC分期依据第七版美国抗癌联合会(American Joint Committee on Cancer,AJCC)癌症分期手册。
1.3 免疫组化
免疫组化染色采用链霉亲和素-过氧化物酶(streptavidin-perosidase,SP)法,免疫组化试剂盒(GK500705)购自上海基因科技有限公司。石蜡切片脱蜡、梯度水化,3%H2O2置于37℃恒温箱中5~10 min以灭活内源性酶,将组织切片用柠檬酸缓冲液(PH6.0)进行微波抗原修复,滴加兔抗人CXCL10多克隆抗体(ab9807,Abcam),浓度为1.0 μg/mL(稀释比1∶1000),4℃过夜,PBS冲洗,滴加通用型抗鼠兔IgG(1∶100),37℃恒温箱中30 min,PBS冲洗,DAB显色,苏木素轻度复染,流水冲洗。阴性对照为以磷酸盐缓冲溶液(PBS)代替I抗而其他处理不变的标本。
1.4 CXCL10的表达水平以免疫染色评分代表
CXCL10的表达水平以免疫染色评分代表。由两名对临床病理数据不知情的病理科医生分别对标本的免疫反应性进行评估。每张玻片在高倍镜下选择至少10个具有代表性的视野进行评估。半定量评分由阳性细胞数百分比评分与染色强度评分组成,范围为0~8分。阳性细胞数百分比评分标准如下:每个高倍镜视野中对染色的癌细胞进行计数,有0~5%阳性表达细胞为0分,有6%~25%阳性表达为1分,26%~50%阳性表达为2分,51%~75%阳性表达为3分,76%~100%阳性表达为4分。染色强度评分的标准如下:不存在特异性染色为0分,可疑染色为1分,弱染色为2分,中等强度染色为3分,强染色为4分。
1.5 统计学分析
采用SPSS 22.0统计软件分析数据,非正态分布资料经对数转换后进行分析。统计学方法包括描述性统计、年龄分布采用平均数±标准差描述,t检验、方差分析及pearson相关分析。NG、CLT、PTC组间CXCL10表达水平的比较采用χ2检验、两两比较采用Bonferroni法。所有统计分析均采用双侧检验,P值<0.05认为差异具有统计学意义。
2 结 果
2.1 病例基本资料
本研究中PTC组包括男性20例,女性85例,年龄16~80岁,平均年龄47.3岁。病理分期Ⅰ期49例(46.7%)),Ⅱ期 6例(5.7%),Ⅲ期 33例(31.4%),Ⅳ期17例(16.2%)。NG组包括男性2例,女性18例,平均年龄50.3岁。CLT组包括男性2例,女性18例,平均年龄52.6岁。
2.2 CXCL10在PTC、NG、CLT组织中的表达
以CXCL10多克隆抗体为一抗,免疫组化可见CXCL10特异性染色存在于PTC细胞的胞浆,以及部分CLT组织中的滤泡立方上皮细胞的胞浆中(图1),而NG组织中未见特异性染色。各组CXCL10染色评分有显著差异(表1)。对各组染色评分两两比较,PTC组染色评分显著高于NG组(P<0.001)及CLT组(P<0.001),CLT组染色评分显著高于NG组(P<0.001)。
表1 CXCL10在不同甲状腺组织病理类型中的表达
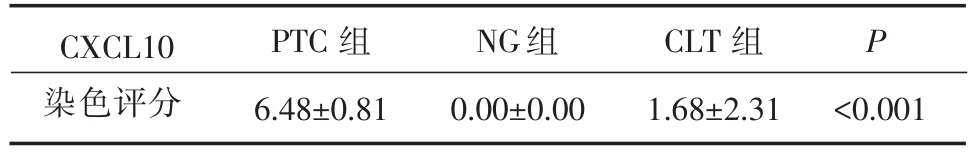
CXCL10染色评分PTC组6.48±0.81 NG组0.00±0.00 CLT组1.68±2.31 P<0.001
2.3 CXCL10的表达与PTC临床特征及术前超声征象的相关性
表2 PTC患者的临床病理资料及免疫组化染色评分(n=105)
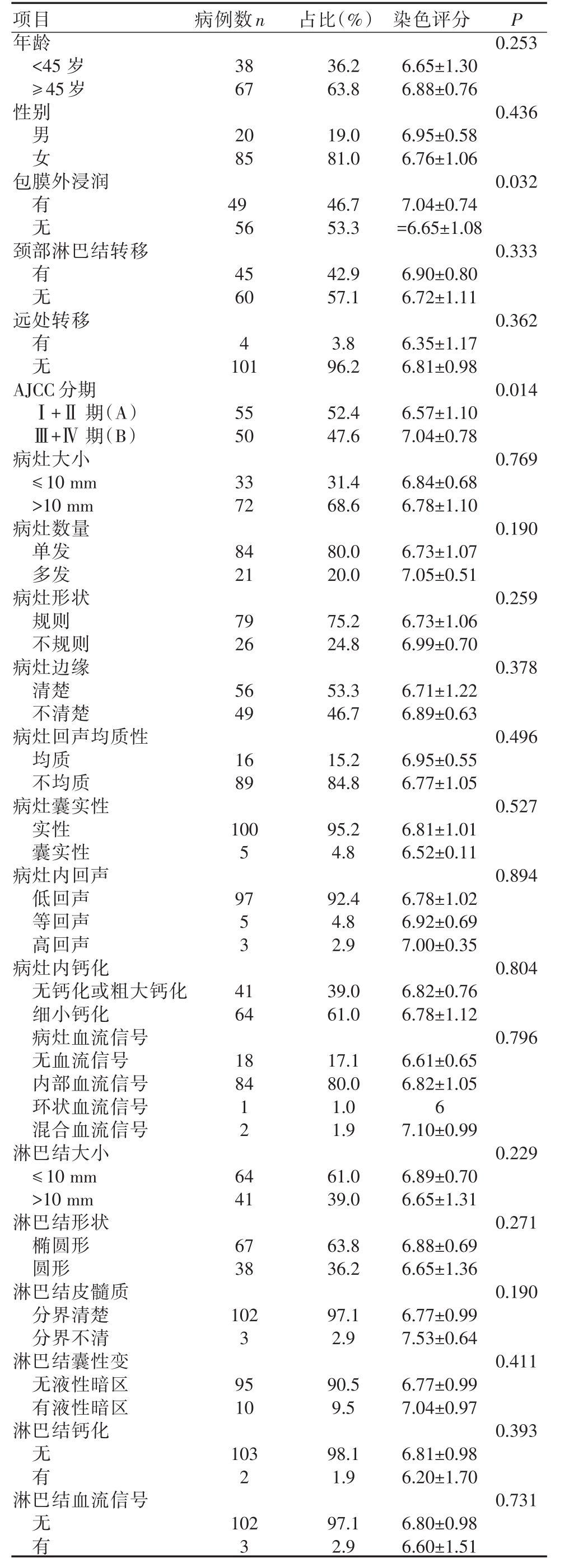
0.253年龄<45岁≥45岁性别0.436男女包膜外浸润0.032有无颈部淋巴结转移0.333有无远处转移0.362有无AJCC分期Ⅰ+Ⅱ期(A)Ⅲ+Ⅳ 期(B)病灶大小≤10 mm>10 mm病灶数量单发多发病灶形状规则不规则病灶边缘清楚不清楚病灶回声均质性均质不均质病灶囊实性实性囊实性病灶内回声低回声等回声高回声病灶内钙化无钙化或粗大钙化细小钙化病灶血流信号无血流信号内部血流信号环状血流信号混合血流信号淋巴结大小≤10 mm>10 mm淋巴结形状椭圆形圆形淋巴结皮髓质分界清楚分界不清淋巴结囊性变无液性暗区有液性暗区淋巴结钙化38 67 20 85 49 56 45 60 4 101 55 50 33 72 84 21 79 26 56 49 16 89 100 5 97 0.014 0.769 0.190 0.259 0.378 0.496 0.527 0.894 5 3 4 1 0.804 64 18 84 0.796 1 2 6 4 0.229 0.271 0.190 0.411 0.393无有淋巴结血流信号0.731无有41 67 38 102 3 95 10 103 2 102 3 36.2 63.8 19.0 81.0 46.7 53.3 42.9 57.1 3.8 96.2 52.4 47.6 31.4 68.6 80.0 20.0 75.2 24.8 53.3 46.7 15.2 84.8 95.2 4.8 92.4 4.8 2.9 39.0 61.0 17.1 80.0 1.0 1.9 61.0 39.0 63.8 36.2 97.1 2.9 90.5 9.5 98.1 1.9 97.1 2.9 6.65±1.30 6.88±0.76 6.95±0.58 6.76±1.06 7.04±0.74=6.65±1.08 6.90±0.80 6.72±1.11 6.35±1.17 6.81±0.98 6.57±1.10 7.04±0.78 6.84±0.68 6.78±1.10 6.73±1.07 7.05±0.51 6.73±1.06 6.99±0.70 6.71±1.22 6.89±0.63 6.95±0.55 6.77±1.05 6.81±1.01 6.52±0.11 6.78±1.02 6.92±0.69 7.00±0.35 6.82±0.76 6.78±1.12 6.61±0.65 6.82±1.05 6 7.10±0.99 6.89±0.70 6.65±1.31 6.88±0.69 6.65±1.36 6.77±0.99 7.53±0.64 6.77±0.99 7.04±0.97 6.81±0.98 6.20±1.70 6.80±0.98 6.60±1.51
PTC患者的临床病理资料、超声资料汇总见表2。CXCL10在不同年龄分组(<45岁或≥45岁)及不同性别PTC中的表达无明显差异。而有甲状腺包膜外浸润者的PTC组织中CXCL10表达显著高于无包膜外浸润者(P<0.05);有无颈部淋巴结转移及远处转移者的CXCL10表达无明显统计学差异(P>0.05)。根据AJCC分期,把免疫组化标本分为两组:(Ⅰ期+Ⅱ期)组和(Ⅲ期+Ⅳ期)组,比较两组最终染色评分,结果示(Ⅲ期+Ⅳ期)组的染色评分显著高于(Ⅰ期+Ⅱ期)组(P<0.05)(表2)。PTC中CXCL10的表达水平与术前超声征象如病灶数量、大小、回声、钙化、血流情况、淋巴结大小、形状、边界、囊实性、钙化均无显著相关性(表2)。
3 讨 论
CXCL10基因在正常细胞中常常呈低表达,在疾病状态下主要由γ-干扰素(interferon-γ,IFN-γ)与肿瘤坏死因子α(tumor necrosis factor α,TNF-α)共同刺激产生剂量依赖性的表达增加[2]。CXCL10通过与其受体CXCR3结合发挥作用,在诱导效应CD8+T细胞、Th1细胞和NK细胞向炎症部位浸润中起着关键的作用。既往研究显示CXCL10的表达与多种自身免疫性疾病相关[3],CLT患者血清中CXCL10的水平显著高于正常人或结节性甲状腺肿患者[4]。本研究在结节性甲状腺肿(NG)组织中未检测到CXCL10的表达,而在慢性淋巴细胞性甲状腺炎(CLT)组织中有明显的表达,这与既往的研究结果是一致的。CLT是一种以弥漫性淋巴细胞浸润为特征的甲状腺组织进行性损伤的自身免疫性疾病,临床表现为明显的甲状腺功能减退。CXCL10在IFN-γ的刺激下,可由多种细胞如T淋巴细胞、单核细胞、成纤维细胞、甲状腺细胞等分泌,诱导Th1细胞至炎症部位分泌更多的IFN-γ和TNF-α,从而形成CXCL10分泌的反馈放大回路,导致炎症的持续、组织损伤及自身免疫性抗体的产生[5]。CXCL10在CLT中的表达增加可能存在类似的机制。Rotondi M。等研究发现,CLT组织中浸润淋巴细胞的CXCR3表达上调,与CXCL10结合后通过诱导Th1细胞的趋化作用,引起甲状腺细胞的凋亡从而导致严重甲减[5]。Antonelli等研究表明CXCL10与甲减的相关性比甲状腺自身抗体与甲减的相关性更强,CXCL10升高可能是甲状腺炎活动程度的一个标志[6]。此外,本研究观察到CXCL10在甲状腺滤泡立方上皮细胞的胞浆中有明显的表达,这提示甲状腺滤泡立方上皮细胞在CLT的自身免疫中可能参与了局部趋化因子的合成以及炎症细胞的募集。但CLT的CXCL10表达水平表现出明显的个体差异,可能与患者的病程、病情、局部炎症反应强度以及自身抗体水平等有关。
既往研究显示慢性炎症可通过触发免疫抑制和破坏抗癌免疫反应从而导致肿瘤的发生与进展[7]。本研究结果显示CXCL10在PTC组织中的表达水平显著高于NG组织,甚至显著高于CLT组织,这可能与PTC肿瘤微环境中淋巴细胞浸润增加以及CXCL10基因的表达被激活有关。在肿瘤微环境中,肿瘤细胞可通过自分泌或旁分泌方式产生趋化因子,与细胞表面相应受体结合,维持肿瘤细胞生长、促进血管增生,促进肿瘤细胞运动,获得远处转移的能力。细胞实验研究表明,CXCL10可能参与促进了恶性肿瘤的进展。PTC细胞中CXCL10的分泌明显增加,与PTC的增殖与转移相关[2,8]。在 PTC 中,RET 基因重排和BRAF/RAS基因突变均可激活CXCL10基因的转录,上调的CXCL10刺激了PTC的增殖和侵袭[3,9]。CXCL10 在肝移植后表达上调,诱导内皮祖细胞动员、分化和新生血管形成,进而促进肝癌生长。靶向抑制CXCL10/CXCR3信号可以预防移植后晚期肝癌复发和转移[10]。此外,CXCL10表达的下调可抑制多种恶性肿瘤如黑色素瘤、结肠癌、和乳腺癌的远处转移率。这与本研究中CXCL10的表达水平与PTC的不良预后相关是一致的。CXCL10的这种促肿瘤机制可能与肿瘤特殊的微环境常导致浸润的淋巴细胞免疫无有关,CXCL10招募Tregs细胞进入肿瘤微环境,阻断NK细胞的功能,从而导致免疫抑制。此外,体外实验表明CXCL10可显著增加肿瘤微环境中的内皮祖细胞的浓度,促进内皮祖细胞的活化及分化,诱导血管形成[10]。但有趣的是,CXCL10及其受体CXCR3可能也具有一定的抗肿瘤作用。CXCL10能与CXCR3结合,诱导效应细胞CD4+/CD8+T细胞向肿瘤部位浸润,诱导肿瘤细胞凋亡,从而抑制肿瘤生长。CXCL10不仅可以与CXCR3结合介导细胞凋亡,也可与TLR4受体结合,使白激酶B及Jun氨基末端激酶的激活,导致caspase-8、caspase-3及p21-活化激酶2裂解使细胞凋亡。激活CXCR3受体可以进一步激活MAPK(ERK1/2 P38 JNK)、PI3K/Akt、ERK1/2、Akt等信号通路[11]。CXCL10这种不同的生物学效应可能与CXCL10受体类型(CXCR3A、CXCR3B和CXCR3-alt)的不同有关,这些配体在不同的细胞类型及疾病的不同阶段中的表达不相一致。
AJCC癌症分期系统是目前甲状腺癌临床诊治中应用最为广泛的预后评估的重要参考标准之一。本研究首次发现AJCCⅢ+Ⅳ期病例中CXCL10的表达水平显著高于AJCCⅠ+Ⅱ期。进一步相关性分析结果显示CXCL10的表达水平与PTC的甲状腺包膜外侵犯相关,而与淋巴结转移无明显相关性,提示CXCL10可能主要参与PTC细胞的局部侵袭能力的调控,从而影响PTC患者的预后。Mulligan AM。等的研究发现,过表达CXCL10的乳腺癌细胞的培养基上清液可促进T淋巴细胞的迁移和浸润[12]。因此,CXCL10在PTC中可能类似地通过旁分泌及自分泌作用影响肿瘤微环境,促进肿瘤细胞的局部侵袭浸润[13]。有研究者尝试使用CXCL9/10/11的表达水平对肿瘤患者的预后风险进行系统评分[14],我们的研究结果也证明了高水平的CXCL10与PTC的不良预后相关,因此未来CXCL10可能作为PTC潜在的生物标记物或预后指标。PTC和CLT之间的关系一直是众多研究的焦点。Lee等人的一项大型荟萃分析显示,与良性病变和不同肿瘤组织类型者相比,PTC患者出现CLT的频率明显更高。PTC合并CLT不仅与较低的甲状腺外浸润率和淋巴结转移率相关,更重要的是与较低的复发率相关[15]。本研究中PTC中CXCL10的表达明显高于CLT,CLT的免疫微环境是否影响PTC的发展和进展及其分子机制,仍是一个值得讨论的问题。
综上所述,与甲状腺良性疾病相比,CXCL10在PTC组织中显著高表达,可能促进了PTC的局部侵袭,与不良预后相关,可能作为潜在的生物标记物或预后指标。本研究亦首次从新的角度探索了CXCL10的表达与术前超声征象的相关性,发现CXCL10的表达与术前超声征象如病灶数量、大小、回声、钙化、血流情况,淋巴结大小、形状、边界、囊实性、钙化均无显著相关性。但作为单中心的回顾性研究,病例选择可能存在一定偏倚。多中心、前瞻性研究、扩大样本量,以及延长随访时间等将有助于进一步验证本研究结果。对CXCL10的深入研究如CLT与PTC之间关系的探索、PTC中CXCL10与相关免疫微环境如免疫细胞、CXCL10-CXCR3信号通路的探索都将有助于深入阐明PTC的发生发展机制。
参考文献
[1] Lee JH,Kim B,Jin WJ,et al.Pathogenic roles of cxcl10 signaling through cxcr3 and tlr4 in macrophages and t cells:Relevance for arthritis[J].Arthritis Res Ther,2017,19(1):163.
[2] Rotondi M,Coperchini F,Awwad O,et al.Effect of interferongamma on the basal and the tnfalpha-stimulated secretion of cxcl8 in thyroid cancer cell lines bearing either the ret/ptc rearrangement or the braf v600e mutation[J].Mediators Inflamm,2016:8512417.
[3] Antonelli A,Ferrari SM,Giuggioli D,et al.Chemokine(c-x-c motif)ligand(cxcl)10 in autoimmune diseases[J].Autoimmun Rev,2014,13(3):272-280.
[4] Ruffilli I,Ferrari SM,Colaci M,et al.Ip-10 in autoimmune thyroiditis[J].Horm Metab Res,2014,46(9):597-602.
[5] Rotondi M,Chiovato L.The chemokine system as a therapeutic target in autoimmune thyroid diseases:A focus on the interferongamma inducible chemokines and their receptor[J].Curr Pharm Des,2011,17(29):3202-3216.
[6] Antonelli A,Rotondi M,Fallahi P,et al.High levels of circulating cxc chemokine ligand 10 are associated with chronic autoimmune thyroiditis and hypothyroidism[J].J Clin Endocrinol Metab,2004,89(11):5496-5499.
[7] Shalapour S,Karin M.Immunity,inflammation,and cancer:An eternal fight between good and evil[J].J Clin Invest,2015,125(9):3347-3355.
[8] Antonelli A,Ferrari SM,Fallahi P,et al.Variable modulation by cytokines and thiazolidinediones of the prototype th1 chemokine cxcl10 in anaplastic thyroid cancer[J].Cytokine,2012,59(2):218-222.
[9] Melillo RM,Castellone MD,Guarino V,et al.The ret/ptc-rasbraf linear signaling cascade mediates the motile and mitogenic phenotype of thyroid cancer cells[J].J Clin Invest,2005,115(4):1068-1081.
[10] Ling CC,Ng KT,Shao Y,et al.Post-transplant endothelial progenitor cell mobilization via cxcl10/cxcr3 signaling promotes liver tumor growth[J].J Hepatol,2014,60(1):103-109.
[11] Sahin H,Borkham-Kamphorst E,Do ON,et al.Proapoptotic effects of the chemokine,cxcl 10 are mediated by the noncognate receptor tlr4 in hepatocytes[J].Hepatology,2013,57(2):797-805.
[12] Mulligan AM,Raitman I,Feeley L,et al.Tumoral lymphocytic infiltration and expression of the chemokine cxcl10 in breast cancers from the ontario familial breast cancer registry[J].Clin Cancer Res,2013,19(2):336-346.
[13] Yang C,Zheng W,Du W.Cxcr3a contributes to the invasion and metastasis of gastric cancer cells[J].Oncol Rep,2016,36(3):1686-1692.
[14] Liu W,Liu Y,Fu Q,et al.Elevated expression of ifn-inducible cxcr3 ligands predicts poor prognosis in patients with non-metastatic clear-cell renal cell carcinoma[J].Oncotarget,2016,7(12):13976-13983.
[15] Lee JH,Kim Y,Choi JW,et al.The association between papillary thyroid carcinoma and histologically proven hashimoto"s thyroiditis:A meta-analysis[J].Eur J Endocrinol,2013,168(3):343-349.

