胃癌(GC)是世界上最常见的恶性疾病,也是导致癌症死亡的主要原因之一[1]。目前,根治性淋巴结切除术是治疗可切除胃癌的唯一可行的治疗方法[2]。腹腔镜胃切除联合淋巴结清扫已成为早期胃癌的首选治疗方法[3,4]。最近的大型多中心随机临床试验表明,腹腔镜胃切除术对治疗晚期胃癌也是安全有效的[5-7]。
尽管随着手术技术的改进,腹腔镜胃切除术的并发症和死亡率一直很低,但外科医生仍需要注意这些围手术期并发症[8,9]。其中,十二指肠残端漏(duodenal stump leakage,DSL)是胃切除术中最严重的并发症之一。据报道,DSL是一种罕见的并发症,但可能导致高达20%的死亡率[10]。DSL 主要发生在接受 Billroth II(B-II)和 Roux-en-Y(R-Y)重建的患者中,其中存在十二指肠残端。由于腹腔镜手术的要求较高,十二指肠残端的处理存在一些困难。因此,一些外科医生对腹腔镜胃切除术中十二指肠残端的管理有不同的看法。一些研究认为,腹腔镜手术会增加DSL的发生率,因此十二指肠残端的加固可以减少DSL的发生[11]。相比之下,大多数研究人员认为十二指肠残端的常规加固不是胃切除术所必需的[12-14]。最近对来自日本的965名患者进行的一项研究表明,腹腔镜十二指肠残端增强可降低R-Y重建期间DSL的发生率。然而,该研究仅限于患有早期胃癌的患者,并且较少的患者(70例)具有未加强的十二指肠残端。此外,重建仅限于R-Y,因为B-II很少在日本进行。因此,该研究对进展期胃癌和进行B-II重建的领域缺乏指导意义。现在,我们的研究进一步研究了腹腔镜胃癌根治术后DSL的危险因素和治疗方法。本研究中纳入的患者包括晚期胃癌,重建方法包括R-Y和B-II。
1 材料与方法
1.1 研究人群
2013年1月至2018年12月期间,在中国科学院大学宁波华美医院所有被诊断为GC的患者接受了RY和B-II腹腔镜胃胃癌根治术的重建。我们从中国科学院大学宁波华美医院的患者数据库中提取,并在本研究中进行回顾性分析。纳入标准为:①组织学证实的原发性胃腺癌;②无胃切除或其他恶性肿瘤史;③具有病理学阴性切除边缘(R0切除)和淋巴结切除术(D1+或更多);④无内脏联合切除术。
1.2 外科手术
根据日本胃癌协会的指南,所有患者均接受了根治性胃切除术和淋巴结切除术(D1+或D2-3)[15]。在使用线性钉将十二指肠残端切割成约2 cm长度后,对十二指肠残端进行不同的处理。未加强组的十二指肠残端未进行额外治疗。十字形残端在加固组中以不同方式加固,包括连续缝合,间断缝合,半荷包缝合和腹腔镜下完整荷包缝合,所有缝合均用手进行。缝合深度包括全层或肌肉层。手术后常规将一个或两个腹腔引流管留在腹腔[13,16-18]。
1.3 手术并发症
DSL定义如下:与正常血清值相比,存在液体认为手术性腹腔引流后胆红素或淀粉酶浓度至少高三倍(排除胰腺瘘/吻合口瘘);或者通过腹壁引流管旁渗漏,无论其临床影响如何,并通过腹部计算机断层扫描(CT)扫描和/或瘘管造影证实[19]。当手术后的前30天或手术后住院期间发生并发症时,应考虑并发症。根据Clavien-Dindo的分类(C-D)评估手术并发症的严重程度。C-D级3a的并发症被认为是事件[20]。
1.4 统计分析
连续数据表示为均数±标准差或具有范围的中值,并且分类数据以百分比表示。使用Logistic回归在多变量模型中评估从单因素分析获得的潜在相关因子。计算比值比(OR)和95%置信区间(CI)。所有统计学检验均为双侧进行,P<0.05被认为具有统计学意义。使用SPSS软件(版本19.0,SPSS Inc.IL,USA)进行分析。
2 结果
2013年1月至2018年12月,中国科学院大学宁波华美医院接受了腹腔镜胃癌根治术的779例患者。其中,根据纳入标准排除了总共358名患者。最后,421名患者符合我们的分析条件(174名R-Y患者和247名B-II患者)(图1)。
对于临床特征,男性的数量是女性的接近3倍,绝大多数(94.1%)的患者是美国麻醉医师协会(ASA)1~2级。接近一半(39.9%)的患者体质指数在正常范围外,近三分之一的患者有不同程度的贫血。外科手术的分析如下:毕Ⅱ式重建手术的患者略多于Roux-en-Y吻合患者。中位手术时间为220 min,失血量为50 mL。此外,283例(67.2%)患者接受十二指肠残端加固,其余138例患者未接受十二指肠残端加固。顺便提一下,近三分之二的患者属于较晚期胃癌(Ⅱ~Ⅲ期),详见表1。
表1 临床资料数据情况
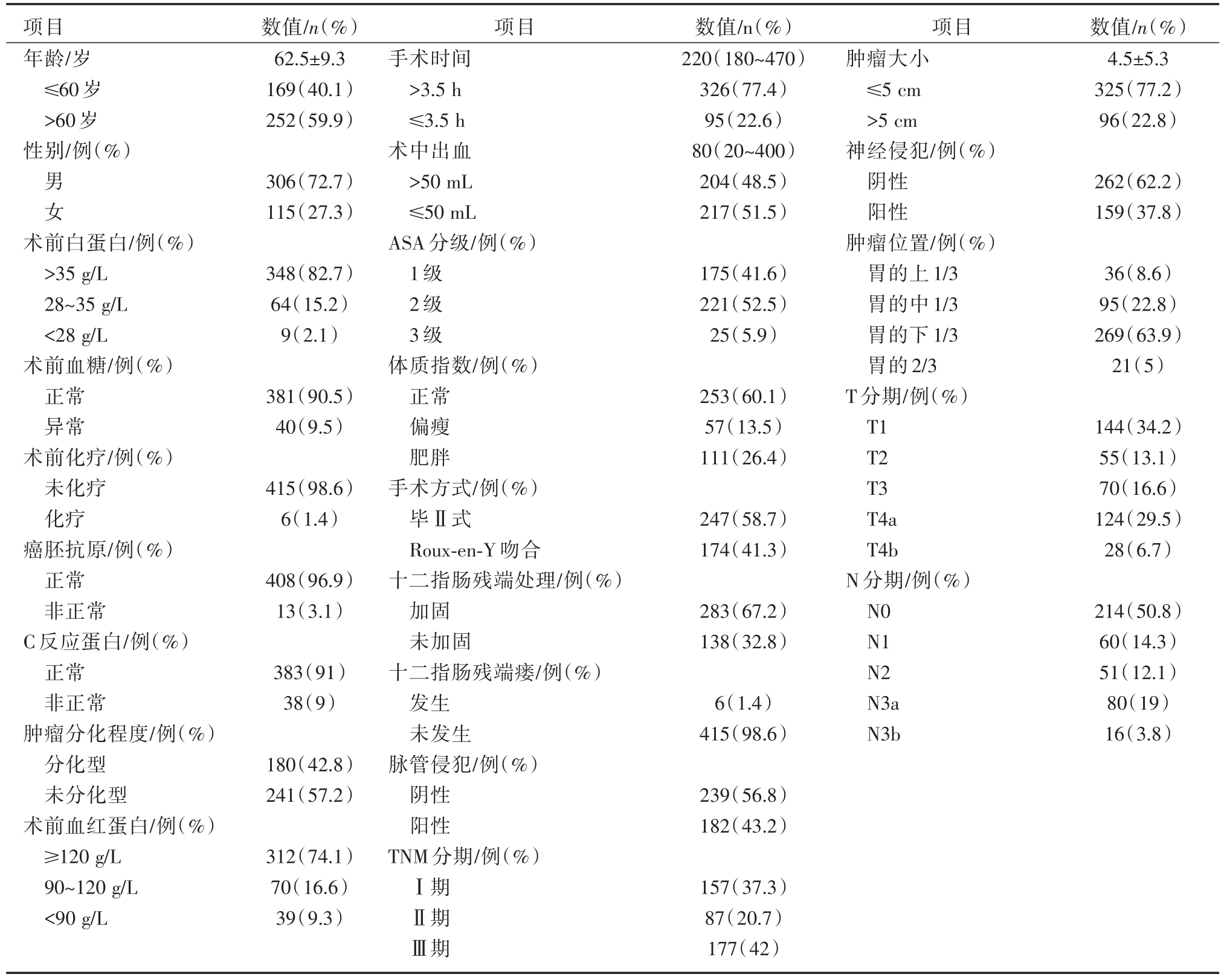
项目年龄/岁≤60岁>60岁性别/例(%)数值/n(%)62.5±9.3 169(40.1)252(59.9)数值/n(%)4.5±5.3 325(77.2)96(22.8)男女306(72.7)115(27.3)数值/n(%)220(180~470)326(77.4)95(22.6)80(20~400)204(48.5)217(51.5)262(62.2)159(37.8)术前白蛋白/例(%)>35 g/L 28~35 g/L<28 g/L术前血糖/例(%)正常异常术前化疗/例(%)未化疗化疗癌胚抗原/例(%)正常非正常C反应蛋白/例(%)正常非正常肿瘤分化程度/例(%)分化型未分化型术前血红蛋白/例(%)≥120 g/L 90~120 g/L<90 g/L 348(82.7)64(15.2)9(2.1)175(41.6)221(52.5)25(5.9)36(8.6)95(22.8)269(63.9)21(5)381(90.5)40(9.5)253(60.1)57(13.5)111(26.4)415(98.6)6(1.4)247(58.7)174(41.3)144(34.2)55(13.1)70(16.6)124(29.5)28(6.7)408(96.9)13(3.1)283(67.2)138(32.8)383(91)38(9)6(1.4)415(98.6)项目肿瘤大小≤5 cm>5 cm神经侵犯/例(%)阴性阳性肿瘤位置/例(%)胃的上1/3胃的中1/3胃的下1/3胃的2/3 T分期/例(%)T1 T2 T3 T4a T4b N分期/例(%)N0 N1 N2 N3a N3b 214(50.8)60(14.3)51(12.1)80(19)16(3.8)180(42.8)241(57.2)239(56.8)182(43.2)312(74.1)70(16.6)39(9.3)项目手术时间>3.5 h≤3.5 h术中出血>50 mL≤50 mL ASA分级/例(%)1级2级3级体质指数/例(%)正常偏瘦肥胖手术方式/例(%)毕Ⅱ式Roux-en-Y 吻合十二指肠残端处理/例(%)加固未加固十二指肠残端瘘/例(%)发生未发生脉管侵犯/例(%)阴性阳性TNM分期/例(%)Ⅰ期Ⅱ期Ⅲ期157(37.3)87(20.7)177(42)
2.1 手术并发症
51例患者发生C-D级3~5级并发症,发生率为12.1%,其中39例为3a级,9例为3b级,2例为4级,1例为5级。肺部并发症发生在23例患者(5.5%)。还有其他并发症,包括吻合口瘘(n=9),肠梗阻(n=6),腹腔脓肿(n=5),术后出血(n=3,伤口并发症(n=3),胰腺炎(n=1)和脑梗塞(n=1)。另一例死于呼吸衰竭,死亡率为0.24%。
2.2 DSL的风险因素
共观察到6例DSL患者(1.43%)。分析了23个可变参数。根据单变量分析,证实以下2种临床病理学特征与DSL有关:术前C反应蛋白(CRP),十二指肠残端加固及另外三种因素P值较小癌胚抗原、术前白蛋白和术前血红蛋白(表2)。在多变量Cox比例风险模型分析中,术前CRP和十二指肠残端加固是DSL最重要的独立危险因素(表3)。CRP正常的患者DSL率为0.7%,CRP异常患者为7.9%(>6 mg/L)。DSL发生的十二指肠残端加固和未加固组的概率分别为0.7%和1.8%。
2.3 DSL患者的详细信息
在DSL患者中,6名全是男性。只有一例是ASA 3,其余的是 ASA 1。平均 BMI为 24.6 kg/m2,3名患者超重或肥胖(BMI>24 kg/m2)。手术前3名患者的CRP升高。5例患者未加强十二指肠残端。DSL的诊断时间为2~9天,中位数为3.5天。3名患者接受了保守治疗,3名患者接受了穿刺治疗。所有患者在治疗后均恢复,无死亡。术后平均住院天数约为15天(表4)。
表2 十二指肠残端泄漏危险因素的单因素分析

NA:无法使用
95%CI P值95%CI P值年龄(ref:<60岁)≥60岁性别(ref:男)女手术方式(ref:毕Ⅱ式)Roux-en-Y体质指数(ref:正常)偏瘦肥胖术前化疗(ref:未化疗)化疗癌胚抗原(ref:正常)异常C反应蛋白(ref:正常)异常术前血红蛋白(ref:≥120 g/L)90~120 g/L<90 g/L术前白蛋白(ref:>35 g/L)28~35 g/L<28 g/L肿瘤分化程度(ref:分化型)未分化型ASA分级(ref:1级)2级3级手术时间(ref:>3.5 h)≤3.5 h OR 1 1.347 1 NA 1 1.427 1 0.432 NA 1 NA 1 6.717 1 10.857 1 0.24 NA 1 0.177 NA 1 1.502 1 0.706 NA 1 0.683 0.24-7.440.733 0.19-4.710.939术中出血(ref:>50 mL)≤50 mL十二指肠残端处理(ref:未加固)加固术前血糖(ref:正常)异常肿瘤位置(ref:胃的上1/3)胃的中1/3胃的下1/3胃的2/3肿瘤大小(ref:≤5 cm)>5 cm神经侵犯(ref:阴性)阳性脉管侵犯(ref:阴性)阳性T分期(ref:T1)T2 T3 T4a T4b N分期(ref:N0)N1 N2 N3a N3b TNM分期(ref:Ⅰ期)Ⅱ期Ⅲ期OR 1 0.939 1 0.094 1 1.928 1 NA NA NA 1 NA 1 0.822 1 1.318 1 0.189 1.019 NA 0.443 1 NA NA NA NA NA 3.429 4.141 0.01-0.820.032 0.29-7.150.6660.22-16.930.554 0.09-2.180.309 0.73-62.000.093 0.15-4.540.822 2.11-55.820.004 0.26-6.610.737 0.04-1.360.106 0.01-3.11 0.09-11.75 0.244 0.988 0.01-1.120.062 0.04-5.060.443 0.27-8.290.641 0.08-6.300.755 0.08-5.920.729 0.35-33.30 0.37-46.31 0.288 0.249
表3 十二指肠残端瘘危险因素的多因素分析
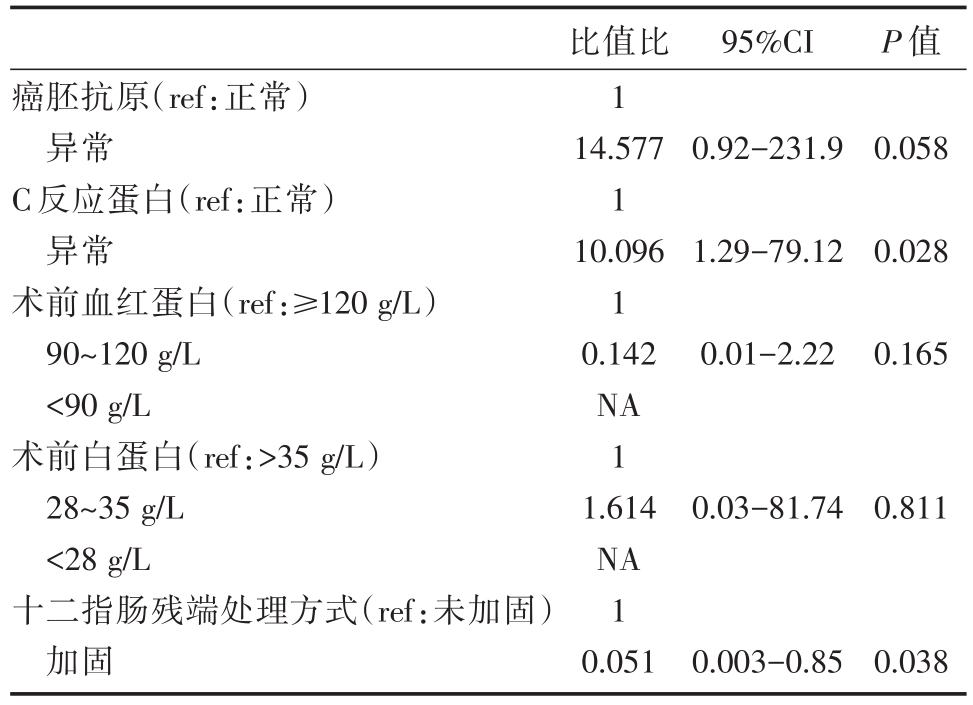
NA:无法使用
95%CI P值癌胚抗原(ref:正常)异常C反应蛋白(ref:正常)异常术前血红蛋白(ref:≥120 g/L)90~120 g/L<90 g/L术前白蛋白(ref:>35 g/L)28~35 g/L<28 g/L十二指肠残端处理方式(ref:未加固)加固比值比1 14.577 1 10.096 1 0.142 NA 1 1.614 NA 1 0.051 0.92-231.90.058 1.29-79.120.028 0.01-2.220.165 0.03-81.740.811 0.003-0.850.038
3 讨论
DSL是一种罕见的胃癌根治术术后并发症,但它非常致命。它可导致腹腔感染和出血,显著延长术后住院时间,增加治疗费用和死亡率[21,22]。在剖腹手术中,十二指肠残端通常是加强的。目前,微创技术,尤其是腹腔镜技术已广泛应用于GC的外科治疗,但未对十二指肠残端的管理达成共识。此外,腹腔镜胃癌根治术中DSL的危险因素存在争议。
在这项研究中,接受腹腔镜胃癌根治术的患者接受R-Y/B-II重建GC的患者有十二指肠残端。结果显示,DSL的发生率为1.43%,与以往的研究结果一致。Cozzaglio[11]分析了8000多例GC(剖腹术7987例,腹腔镜281例),发现腹腔镜手术增加了 DSL 的风险(OR=5.6)。相反,Paik[23],Ail[19]和大多数研究人员报道,腹腔镜胃癌根治术与DSL的发生无关。
然后,本研究分析了一系列临床因素,结果显示年龄、性别、ASA评分、CEA、体重指数、血红蛋白和白蛋白等与DSL无显著相关性。有趣的是,术前升高的CRP可能会增加腹腔镜胃癌根治术后DSL的发生率。一些研究表明,患有多种合并症和营养障碍的患者可能具有较高的DSL风险[23,24]。然而,Ri[25]的结果与我们的结果相同,ASA评分和营养状况与腹腔镜胃癌根治术后的DSL无关。原因可能是本研究中包括少数患有合并症和营养不良的患者。
表4 十二指肠残端瘘患者的详细信息
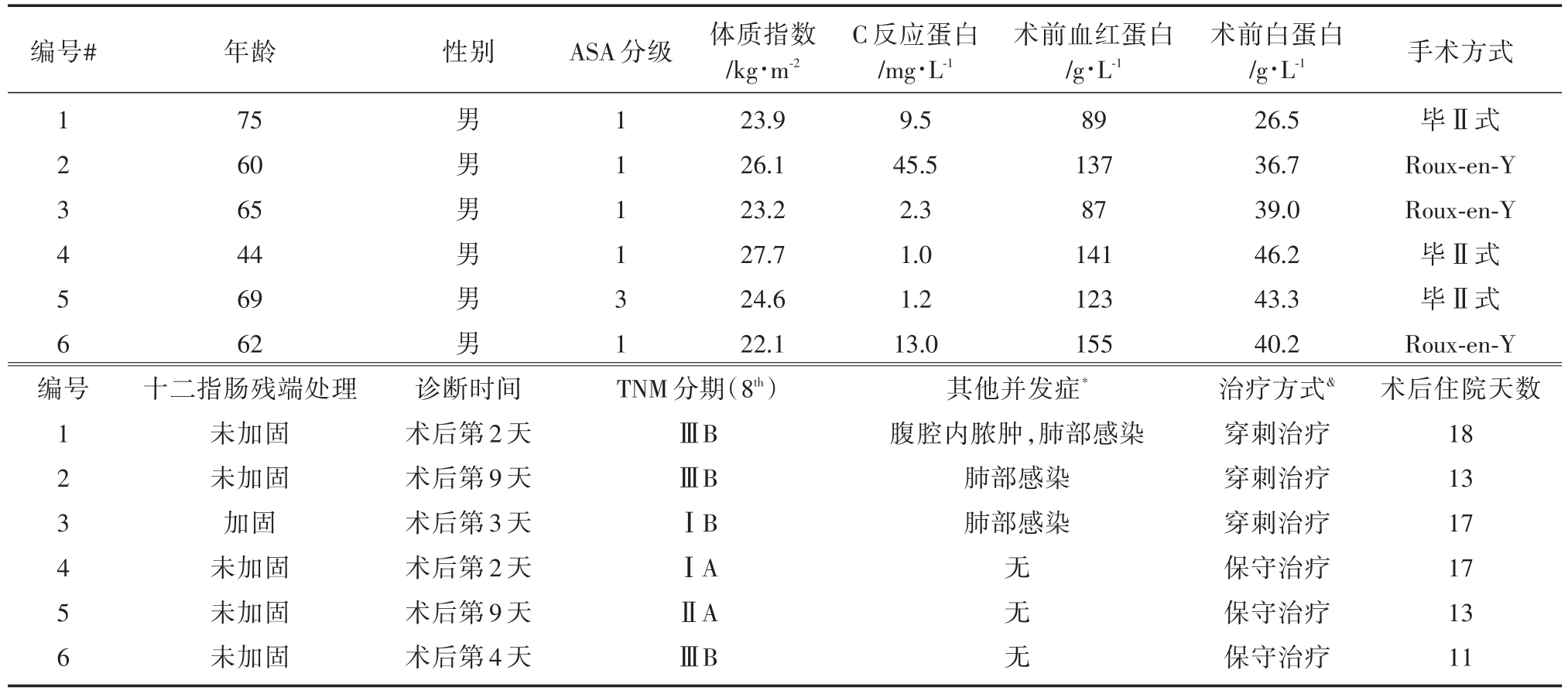
*除十二指肠残端漏出以外的并发症(C~D级3~5级);#没有患者接受新辅助化疗;& 所有患者均在治疗后康复。
编号#性别ASA分级1 2 3 4 5 6编号1 2 3 4 5 6年龄75 60 65 44 69 62十二指肠残端处理未加固未加固加固未加固未加固未加固男男男男男男1 1 1 1 3 1体质指数/kg?m-2 23.9 26.1 23.2 27.7 24.6 22.1术前血红蛋白/g?L-1 89 137 87 141 123 155诊断时间术后第2天术后第9天术后第3天术后第2天术后第9天术后第4天TNM分期(8th)ⅢBⅢBⅠBⅠAⅡAⅢB C反应蛋白/mg?L-1 9.5 45.5 2.3 1.0 1.2 13.0其他并发症*腹腔内脓肿,肺部感染肺部感染肺部感染无无无术前白蛋白/g?L-1 26.5 36.7 39.0 46.2 43.3 40.2治疗方式&穿刺治疗穿刺治疗穿刺治疗保守治疗保守治疗保守治疗手术方式毕Ⅱ式Roux-en-Y Roux-en-Y毕Ⅱ式毕Ⅱ式Roux-en-Y术后住院天数18 13 17 17 13 11
最重要的是,我们的研究表明CRP术前异常是腹腔镜胃切除术后DSL的危险因素之一。回顾以往的研究,这是这一现象的第一次报道。但具体机制尚不清楚。许多先前的研究表明,术前CRP水平是发病率和死亡率升高的独立且重要的指标,包括肺切除术[27],胰十二指肠切除术[28]和心脏手术[29]。此外,其他研究表明,术前CRP可预测长期生存,如结直肠癌[30]、胃癌[31,32]和肾癌[33]。最近的一项随机临床试验表明,术前C反应蛋白-白蛋白比率是早期复发和术后辅助化疗反应的有希望的预测指标[34]。然而,分子生物学机制尚未阐明。
外科手术参数与DSL之间的关系存在争议。Orsenigo[24],Ri[25]和 Ramos[26]认为 D2 淋巴结清扫术和胃大部切除术是DSL的危险因素,但我们的结果与大多数研究相似,除了十二指肠残端的加固其他因素包括胃切除术的类型、重建方法、手术时间、术中出血量、淋巴结清扫术与DSL的发生无直接关系。一项涉及100名患者的2期临床试验显示,腹腔镜加固缝合可防止十二指肠残端瘘发生[35]。之前的两项研究表明,腹腔镜十二指肠残端加固可降低DSL的风险。尽管如此,在这两项研究中,重建模式主要是 R-Y[24,25]。此外,十二指肠残端加固不仅可以降低DSL的发生率,而且可以降低腹腔镜胃癌根治术后的严重程度。十二指肠残端加固增加了手术时间,但没有增加术中失血或其他并发症的风险。最近,具有生物可吸收聚乙醇酸片的线性吻合装置可用于加强十二指肠残端而无需手动缝合,最终降低了DSL的发生率[36]。
在该研究中未发现肿瘤特征(包括位置、大小、分化和TNM分期)与DSL之间的关联。根据Ramos[26],远端胃肿瘤是 DSL 的危险因素之一。更重要的是,DSL可能会降低GC患者的长期生存率。另外,通过Paik的研究胃出口梗阻可以增加DSL的发生[23]。其机制可能是位于远端胃中的肿瘤更容易出现胃出口阻塞,这会导致粘膜水肿和全身营养受损,所有这些都会增加DSL的风险。
众所周知,DSL是最严重的并发症之一,但幸运的是,所有患者在本研究中治疗后都恢复了。包括这一项在内的大量研究表明,虽然DSL可以在手术后的不同时间发生,但最常见的时间是术后一周。对包括294名DSL患者在内的20项研究进行的系统评价显示,DSL诊断发生在术后第5天和第10天之间[37]。许多DSL患者出现了多种并发症,包括但不限于败血症、腹腔脓肿、伤口感染、肺炎和腹腔内出血。在这项研究中,一些DSL患者有其他并发症,但并不严重。我们的经验是,一旦发生这些并发症,就需要早期干预。
DSL的治疗包括保守、经皮、内窥镜和手术治疗,人们普遍认为非手术治疗是首选,手术方法应保留用于严重病例或非手术方法失败。Cornejo[38]认为保守治疗与手术相比有更好的结果。Paik[23]报道了16例DSL,其中3例接受再次手术治疗。3例手术患者都是在术后1~2天内再次手术。Ali[19]报道所有 DSL患者(n=19)均成功接受了非手术治疗,没有患者死亡。一项研究包括10例DSL患者,其中4例接受了未加强的十二指肠残端,并在DSL后再次手术。相比之下,6例患者接受了十二指肠残端加固治疗,在DSL诊断后,只有一例接受了再次手术,其余患者接受了保守治疗[25]。其他研究报道了在治疗DSL时使用内窥镜夹闭术[39]。
非常重要的是,在中国,如果患者有十二指肠残端,则在胃癌根治术术后常规放置1至2根腹腔内引流管,其中一个将接近十二指肠残端。DSL可根据引流管引流液的淀粉酶情况进行诊断。此外,一旦被诊断为DSL,该引流管可继续排出残端周围的液体,降低腹腔内感染的风险并促进十二指肠残端的愈合。然而,Schots[40]认为腹腔引流和淀粉酶测量不影响GC早期识别和管理泄漏,但仅包括三名患有DSL的患者。因此,我们建议在腹腔镜胃癌根治术中加强十二指肠残端,以降低DSL的风险,特别是对于有危险因素的患者。
虽然我们采用科学严谨的方法来分析这项研究,但本研究仍存在一些不足之处。这项研究是一项回顾性研究,其中包含一些不可避免的缺陷,包括选择偏倚和回忆偏倚。此外,本研究纳入的患者来自中国,这是一个GC发病率高的地区,这一结论不能直接应用于西方国家。最后,本研究中十二指肠残端加固的方法包括各种方法,无法分析它们之间的差异。因此,本研究的结论需要通过大型多中心临床试验进一步验证。
我们的研究表明,腹腔镜胃癌根治术后DSL的发生率很低。DSL的主要危险因素是术前CRP异常和十二指肠非加固残端。保守治疗是DSL的首选治疗方法,大多数患者可以成功治疗。
参考文献
[1] Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statis-tics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394-424.
[2] Sasako M,Sano T,Yamamoto S,et al.D2 lymphadenectomy alone or with para-aortic nodal dissection for gastric cancer[J].N Engl J Med,2008,359(5):453-462.
[3] Lee CM,Park S,Park SH,et al.Sentinel Node Mapping Using a Fluorescent Dye and Visible Light During Laparoscopic Gas-trectomy for Early Gastric Cancer:Result of a Prospective Study From a Single Institute[J].Ann Surg,2017,265(4):766-773.
[4] Jung DH,Lee Y,Kim DW,et al.Laparoscopic proximal gas-trectomy with double tract reconstruction is superior to laparo-scopic total gastrectomy for proximal early gastric cancer[J].Surg Endosc,2017,31(10):3961-3969.
[5] Yu J,Huang C,Sun Y,et al.Effect of Laparoscopic vs Open Distal Gastrectomy on 3-Year Disease-Free Survival in Patients With Locally Advanced Gastric Cancer:The CLASS-01 Ran-domized Clinical Trial[J].Jama,2019,321(20):1983-1992.
[6] Lee HJ,Hyung WJ,Yang HK,et al.Short-term Outcomes of a Multicenter Randomized Controlled Trial Comparing Laparo-scopic Distal Gastrectomy With D2 Lymphadenectomy to Open DistalGastrectomy forLocally Advanced Gastric Cancer(KLASS-02-RCT)[J].Ann Surg,2019,270(6):983-991.
[7] Kinoshita T,Uyama I,Terashima M,et al.Long-term Out-comes of Laparoscopic Versus Open Surgery for Clinical Stage II/III Gastric Cancer:A Multicenter Cohort Study in Japan(LOC-A Study)[J].Ann Surg,2019,269(5):887-894.
[8] Lee MS,Ahn SH,Lee JH,et al.What is the best reconstruc-tion method after distal gastrectomy for gastric cancer[J]?Surg Endosc,2012,26(6):1539-1547.
[9] Kawamura H,Ohno Y,Ichikawa N,et al.Anastomotic compli-cations after laparoscopic total gastrectomy with esophagojeju-nostomy constructed by circular stapler(OrVil(™))versus lin-ear stapler(overlap method)[J].Surg Endosc,2017,31(12):1-8.
[10] Aurello P,Sirimarco D,Magistri P,et al.Management of duo-denal stump fistula after gastrectomy for gastric cancer:System-atic review[J].World J Gastroenterol,2015,21(24):7571-7576.
[11] Cozzaglio L,Giovenzana M,Biffi R,et al.Surgical manage-ment of duodenal stump fistula after elective gastrectomy for ma-lignancy:an Italian retrospective multicenter study[J].Gastric Cancer,2016,19(1):273-279.
[12] Inokuchi M,Nakagawa M,Tanioka T,et al.Long-and short-term outcomes of laparoscopic gastrectomy versus open gastrec-tomy in patients with clinically and pathological locally ad-vanced gastric cancer:a propensity-score matching analysis[J].Surg Endosc,2017,32(2):735-742.
[13] Kim CH,Song KY,Park CH,et al.A comparison of outcomes of three reconstruction methods after laparoscopic distal gastrec-tomy[J].J Gastric Cancer,2015,15(1):46-52.
[14] A Japanese Gastric Cancer Association.Japanese gastric cancer treatment guidelines 2010(ver.3)[J].Gastric Cancer,2011,14(2):113-123.
[15] None.Japanese gastric cancer treatment guidelines 2014(ver.4)[J].Gastric Cancer,2017,20(1):1-19.
[16] Komatsu S,Ichikawa D,Kubota T,et al.Clinical outcomes and quality of life according to types of reconstruction following laparoscopy-assisted distal gastrectomy for gastric cancer[J].Surg Laparosc Endosc Percutan Tech,2015,25(1):69-73.
[17] Okuno K,Nakagawa M,Kojima K,et al.Long-term functional outcomes of Roux-en-Y versus Billroth I reconstructions after laparoscopic distal gastrectomy for gastric cancer:a propensity-score matching analysis[J].Surg Endosc,2018,32(11):4465-4471.
[18] Songun I,Putter H,Kranenbarg EM,et al.Surgical treatment of gastric cancer:15-year follow-up results of the randomised nationwide Dutch D1D2 trial[J].Lancet Oncol,2010,11(5):439-449.
[19] Ali BI,Park CH,Song KY,et al.Outcomes of Non-Operative Treatment for Duodenal Stump Leakage after Gastrectomy in Pa-tients with Gastric Cancer[J].J Gastric Cancer,2016,16(1):28-33.
[20] Dindo D,Demartines N,Clavien PA,et al.Classification of surgical complications:a new proposal with evaluation in a co-hort of 6336 patients and results of a survey[J].Ann Surg,2004,240(2):205-213.
[21] Cozzaglio L,Cimino M,Mauri G,et al.Percutaneous transhe-patic biliary drainage and occlusion balloon in the management of duodenal stump fistula[J].J Gastrointest Surg,2011,15(11):1977-1981.
[22] Kang KC,Cho GS,Han SU,et al.Comparison of Billroth I and Billroth II reconstructions after laparoscopy-assisted distal gas-trectomy:a retrospective analysis of large-scale multicenter re-sults from Korea[J].Surg Endosc,2011,25(6):1953-1961.
[23] Paik HJ,Lee SH,Choi CI,et al.Duodenal stump fistula after gastrectomy for gastric cancer:risk factors,prevention,and management[J].Ann Surg Treat Res,2016,90(3):157-163.
[24] Orsenigo E,Bissolati M,Socci C et al.Duodenal stump fistula after gastric surgery for malignancies:a retrospective analysis of risk factors in a single centre experience[J].Gastric Cancer,2014,17(4):733-744.
[25] Ri M,Hiki N,Ishizuka N,et al.Duodenal stump reinforce-ment might reduce both incidence and severity of duodenal stump leakage after laparoscopic gastrectomy with Roux-en-Y re-construction for gastric cancer[J].Gastric Cancer,2019,22(5):1053-1059.
[26] Ramos M,Pereira MA,Barchi LC,et al.Duodenal fistula:The most lethal surgical complication in a case series of radical gas-trectomy[J].Int J Surg,2018,53:366-370.
[27] Lopez-Pastorini A,Riedel R,Koryllos A,et al.The impact of preoperative elevated serum C-reactive protein on postoperative morbidity and mortality after anatomic resection for lung cancer[J].Lung Cancer,2017,109:68-73.
[28] Mansukhani V,Desai G,Shah R,Jagannath P,et al.The role of preoperative C-reactive protein and procalcitonin as predic-tors of post-pancreaticoduodenectomy infective complications:A prospective observational study[J].Indian J Gastroenterol,2017,36(4):289-295.
[29] Perry TE,Muehlschlegel JD,Liu KY,et al.Preoperative C-re-active protein predicts long-term mortality and hospital length of stay after primary,nonemergent coronary artery bypass grafting[J].Anesthesiology,2010,112(3):607-613.
[30] Egenvall M,Morner M,Martling A,et al.Prediction of out-come after curative surgery for colorectal cancer:preoperative haemoglobin,C -reactive protein and albumin[J].Colorectal Dis,2018,20(1):26-34.
[31] Kim EY,Yim HW,Park CH,et al.C-reactive protein can be an early predictor of postoperative complications after gastrecto-my for gastric cancer[J].Surg Endosc,2017,31(1):445-454.
[32] Crumley AB,McMillan DC,McKernan M,et al.An elevated C-reactive protein concentration,prior to surgery,predicts poor cancer-specific survival in patients undergoing resection for gas-tro-oesophageal cancer[J].Br J Cancer,2006,94(11):1568-1571.
[33] Johnson TV,Abbasi A,Owen-Smith A,et al.Absolute preoper-ative C-reactive protein predicts metastasis and mortality in the first year following potentially curative nephrectomy for clear cell renal cell carcinoma[J].J Urol,2010,183(2):480-485.
[34] Xu BB,Lu J,Zheng ZF,et al.The predictive value of the pre-operative C-reactive protein-albumin ratio for early recurrence and chemotherapy benefit in patients with gastric cancer after radical gastrectomy:using randomized phase III trial data[J].Gastric Cancer,2019,22(5):1016-1028.
[35] Kim MC,Kim SY,Kim KW.Laparoscopic Reinforcement Su-ture(LARS)on Staple Line of Duodenal Stump Using Barbed Suture in Laparoscopic Gastrectomy for Gastric Cancer:a Pro-spective Single Arm Phase II Study [J].J Gastric Cancer,2017,17(4):354-362.
[36] Misawa K,Yoshikawa T,Ito S,et al.Safety and Feasibility of Linear Stapling Device with Bioabsorbable Polyglycolic Acid Sheet for Duodenal Closure in Gastric Cancer Surgery:A Multi-institutional Phase II Study[J].World J Surg,2019,43(1):192-198.
[37] Zizzo M,Ugoletti L,Manzini L,et al.Management of duodenal stump fistula after gastrectomy for malignant disease:a system-atic review of the literature[J].BMC Surg,2019,19(1):55.
[38] Cornejo Mde L,Priego P,Ramos D,et al.Duodenal fistula af-ter gastrectomy:Retrospective study of 13 new cases[J].Rev Esp Enferm Dig,2016,108(1):20-26.
[39] Lee JY,Ryu KW,Cho SJ,et al.Endoscopic clipping of duode-nal stump leakage after Billroth II gastrectomy in gastric cancer patient[J].J Surg Oncol,2009,100(1):80-81.
[40] Schots JPM,Luyer MDP,Nieuwenhuijzen GAP.Abdominal Drainage and Amylase Measurement for Detection of Leakage After Gastrectomy for Gastric Cancer[J].J Gastrointest Surg,2018,22(7):1163-1170.

