腰椎间盘突出症是一种常见的腰椎疾病,常引起腰痛、肌肉痉挛和运动受限[1-3]。腰椎间盘突出症除了通过压迫神经根引起神经根病变相关征象和症状外,腰椎间盘突出症的存在还会影响椎旁肌,但在临床实践中往往被忽视[4-7]。椎旁肌在腰椎功能和结构稳定中起着重要作用,其中最内侧的多裂肌因其独特的神经支配而受到特别关注[8]。与椎旁肌肉系统的其他组成部分不同,多裂肌具有来自节段神经后根内侧支的单侧神经支配。越来越多的文献描述了腰椎间盘突出症患者多裂肌的大小和组成,并使用磁共振成像(MRI)测量[3-8,9-12]。测量多裂肌横截面积的价值一直是一个有争议的话题[13]。然而,通过测量MRI信号强度来间接评估腰椎多裂肌,在描述肌肉疝出的影响方面,已被证明优于横断面面积测量[12,14-17]。然而,这些测量通常是复杂和耗时的,并且需要额外的软件程序,这大大影响了测量工作效率。
本研究的目的是评估单侧腰椎间盘突出症患者L4/L5或L5/S1腰椎多裂肌群的组成,采用MRI视觉定性分级系统,并与MRI信号强度测量的定量结果进行比较。此外,定量和定性结果与症状持续时间和疝的严重程度进行比较。
1 临床资料与方法
1.1 研究人群
本研究回顾性分析从2017年1月至2018年10月我院在放射科进行检查50例患者。研究对象为MRI诊断为单侧后外侧(也称为关节下)椎间盘突出,导致L4/L5或L5/S1水平神经根受压的患者。
纳入标准:患者年龄为≥18周岁;临床诊断为单侧小腿症状,与疝侧及水平一致;均接受脊柱MRI扫描检查。
排除标准:脊柱手术史;恶性肿瘤史;在MRI检查前1个月有急性外伤史的脊柱双侧或多层病变患者;临床症状与MRI不一致的患者;椎旁肌水肿患者。
本研究得到我院伦理委员会的批准。所有参与本研究的对象均签署了书面知情同意书。
1.2 MRI图像获取
所有MRI图像获得均在同一台3.0 T12通道脊柱线圈(Magnetom Avanto;Siemens Medical Solu-tions,Erlangen,Germany)。腰椎MRI包括轴向T2加权像(重复时间[TR]:3370 ms;回波时间[TE]:116 ms;矩阵大小:208×320);矢状面 T2加权像(TR:3370 ms;TE:116ms;矩阵大小:208×320;切片厚度:4 mm,矢状位搅拌顺序(TR,1990 ms;TE,66 ms;反转时间,160 ms;翻转角度,150°;矩阵大小,208×320;切片厚度为4 mm)。所有患者均诊断为L4/L5或L5/S1单侧后外侧疝,引起神经压迫。椎间盘突出被定义为椎间盘突出物向正常椎间盘间隙外突出[18]。神经压迫的严重程度采用由Pfirrmann等人提出的基于MRI的神经压迫分级系统对进行分级[19]。分为:1级,疝与神经接触;2级,神经异常;3级,因疝压迫神经。以上椎棘突下端为标志,从L4/L5或L5/S1水平采集单片T2加权像,得到平行于肌肉平面的图像。然后将获得的图像进行保存,以供进一步评估。腰椎间盘突出症的诊断、第一个数据集的准备和突出症的分级由一位具有20年骨骼肌肉放射学经验的观察者完成。
然后由两名具有5年脊髓MRI经验的调查员评估患者影像资料,他们对症状持续时间和神经压迫的严重程度不知情。此外,通过下棘突获得的单片图像在很大程度上阻止了研究人员识别疝的一侧,这一因素在以前的研究中没有被提及。首先,两名调查员均接受相同时间的指导和训练,定性评估腰椎多裂肌脂肪。评分系统最初提出是使用计算机断层扫描对肩袖肌肉[20]。随着方法的改进后用于评估腰椎多裂肌。该系统由5个等级组成:0级,正常肌肉组织;1级,脂肪条纹;2级,存在明显的脂肪,但少于肌肉组织;3级,脂肪突出,相当于肌肉;4级,大量脂肪超过肌肉组织。在训练期间,两位研究人员评估了这些图像,并自我评估了彼此之间的沟通技巧,以增强测量的一致性。研究人员使用 Image J成像软件(1.43版,National Insti-tutes of Health,Bethesda,MD,USA)在 L4/L5或L5/S1水平对多裂肌进行分级。
经过培训后,研究人员将独立评估这些患者图像的等级。在第一阶段中,使用定性评分系统对图像进行定性分级和评分,然后在下一阶段中,以随机顺序对图像进行重新评估以进行定量测量。为了进行定量测量,研究人员手动以L4/L5或L5/S1水平绘制了腰部多裂肌的边界,并使用Im-ageJ成像软件计算信号强度,其中较高的信号强度等于腰椎内部的更多脂肪。研究人员还在同侧腰大肌上绘制了10 mm的感兴趣区域(ROI),并如前所述计算了多纤维信号强度与腰大肌的比值[23]。对于定量测量,研究人员计算了每个ROI的平均信号值。图1显示了代表性患者的肌肉划分示意图。
1.3 统计学分析
采用SPSS 23.0进行统计分析。定量资料采用平均值±标准差进行统计描述。定量资料符合正态性和方差齐性,统计差异性比较用t检验,Wil-coxon的符号秩检验用于评估多裂肌的定性视觉分级评分。检验水准α定为0.05。
2 结果
2.1 患者的一般临床资料分析
本研究共纳入50例符合要求患者30例男性(60.0%)和20女性(40.0%)。患者一般资料详见表1。
2.2 患者多裂肌在MRI上定性及定量分析
研究显示,患侧多裂肌的信号强度显着高于对侧(表明脂肪含量更高)(P<0.001;见表2)。而在腰大肌信号强度方面发现两侧比较无统计学上差异(P>0.05)。同侧多裂肌与腰大肌信号强度的比较在两组观察者(observer,OB))1和2之间均无明显差异(P>0.05)。而多裂肌与腰大肌信号强度的比值在两侧之间存在统计学上的显著差异,且患侧明显高于健侧。Wilcoxon的符号秩检验用于评估多裂肌的定性视觉分级评分,结果表明,在0级时,健侧多裂肌得分高于患侧(P<0.001;见表2)。
表1 所有纳入患者的一般临床资料的分析

变量性别/例男性女性年龄/岁症状持续时间/月突出严重程度/例1级2级3级突出方向/例右侧左侧数值(n=50,%/±)30(60.0%)20(40.0%)44.88±12.46(24~74)37.82±51.77(10~120)12(24%)15(30%)23(46%)28(56%)22(44%)
表2 单侧腰椎间盘突出症患者多裂肌定量信号强度和视觉定性分级评分

注:OB1/OB2,观察者 1(observer 1)/观察者 2(observer 2)
变量(OB1/OB2)定量测量多裂肌信号强度腰大肌信号强度多裂肌:腰大肌定性测量/例0级1级2级3级4级患侧 健侧P值57.88±11.22/59.61±11.65 31.63±1.10/31.68±1.17 1.83±0.36/1.89±0.36 42.53±5.5/43.41±6.75 31.57±1.12/31.11±1.24 1.35±0.16/1.37±0.23<0.000 0.138<0.001 3(6.0%)/5(10.0%)10(20.0%)/7(14.0%)5(10.0%)/(6(12.0%)12(24.0%)/15(30.0%)16(32.0%)/14(28.0%)25(50%)/20(40.0%)15(30.0%)/18(36.0%)10(20.0%)/7(14.0%)<0.001 0.065 0.057- -
2.3 患者多裂肌与腰大肌的比值与各临床症状之间的分析
两位研究者在患者年龄和患侧多裂肌与腰大肌信号强度比之间均确定了中等正相关性,如表3所示。Spearman的等级相关系数分析显示两位研究者的症状持续时间和视觉上分级的肌肉脂肪含量之间的统计学存在正相关性(分别为P<0.001,r=0.729和r=0.72)。此外,神经压迫的严重程度与肌肉脂肪含量之间存在统计学上的显著相关性(分别为P<0.001,r=0.885和r=0.888)。
表3 各临床症状之间与多裂肌与腰大肌的信号强度比值分析
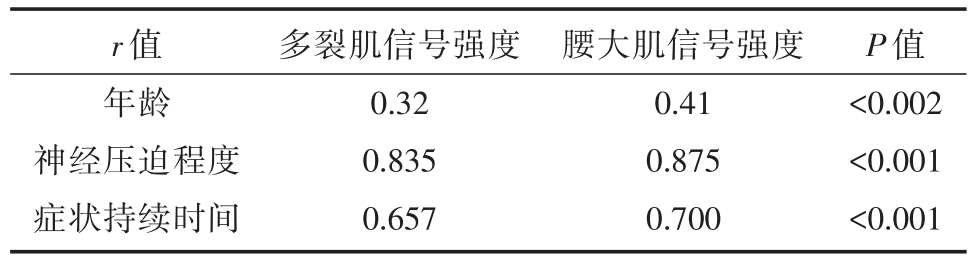
r值年龄神经压迫程度症状持续时间多裂肌信号强度0.32 0.835 0.657腰大肌信号强度0.41 0.875 0.700 P值<0.002<0.001<0.001
3 讨论
有研究表明,腰椎间盘突出症同一水平和同一侧的多裂肌的脂肪组成明显高于对侧,并且多裂肌脂肪含量增加的视觉分级是一种可靠的方法[7,12,17]。目前的研究还确定了肌肉脂肪成分与症状持续时间,肌肉脂肪变化和神经压迫程度之间的实质相关性。公认的腰椎多裂症在腰椎功能中起着重要作用。目前,许多证据表明,腰椎间盘突出症中的多纤维肌功能障碍会对腰椎间盘突出症患者的功能预后产生负面影响,了解肌肉功能障碍的存在和程度将极大地帮助医生制定最合适的康复计划以恢复功能[21-25]。因此,腰椎间盘突出症或神经根损伤患者多指肌的组成和形态已引起广泛关注。关于腰椎间盘突出症对椎旁肌的影响的最早研究发现,在猪神经根损伤模型中,由于神经损伤,多纤维横断面积减少,脂肪含量增加[26]。
基于Hodges等[26]研究的理论基础上,我们进一步探索了与腰椎间盘突出症相关的神经根压迫与腰间多裂肌脂肪浸润之间的潜在关联,与目前的结果相一致。一项测量多裂肌信号强度的研究表明,与L4/L5突出和腿部疼痛症状一致的患者,多裂肌的脂肪含量与突出水平相同,且在同一侧[10]。但是,在这项研究中,肌肉的结构变化在同一侧上很明显,但在突出点以下的一个水平上[17]。据报道,使用一种更直接的半定量测量方法,涉及到肌肉与椎板的距离,在与突出侧和水平上增加,并且肌肉到椎板的距离增加与脂肪萎缩有关[12]。但是,与目前的发现相反,脂肪浸润增加与症状持续时间之间没有关联,这些发表的研究均发现脂肪浸润或脂肪浸润增加以及神经压迫的严重性[12,17]。与目前的结果一致,Wan 等[27]和 Kim等[7]发现腰椎间盘突出症患者的症状持续时间与多裂肌萎缩呈负相关。尽管Wan等[27]的研究重点是评估腰背痛而不是椎间盘突出症,但作者指出,症状持续时间与脂肪浸润以及肌肉萎缩密切相关。
一项使用与本研究相同的视觉分级系统评估单侧L4/L5椎间盘突出患者多裂肌的研究发现,腰椎间盘突出症同一侧的肌肉得分明显更高。但是,尚未探究症状持续时间或突出症严重程度与肌肉组成之间的潜在关联[10]。除了这项已发表的研究,本研究还利用定量和定性方法来测量腰椎间盘突出症患者的多裂肌成分,并证明多裂肌的定性测量与定量方法相当。先前已经研究了Goutal-lier评分系统评估腰椎多裂肌脂肪含量的可行性和可靠性[28]。与目前的研究人群(仅由单侧腰椎间盘突出症患者组成)不同,先前的研究随机包括不同程度的患者与当前结果相似,Goutallier评分系统的结果与使用ImageJ软件获得的定量测量结果相当,此外,视觉观察的脂肪含量分级具有极好的观察者间可靠性。因此,由于直观,实用的视觉评分系统似乎与定量方法一样有效,因此可没有必要应用定量分析,这可能不方便集成到日常解释算法中,尤其是由于放射科医生每天要拍摄的影像数量呈指数级增长,越来越使他们不堪重负。
本研究存在一定局限性。首先,未获得组织学样本以与影像学检查结果进行比较,但是,先前发表的研究表明神经根损伤情况下多纤维的脂肪浸润增加,以及MRI影像神经中多纤维成分改变的能力[29]。因此,笔者认为该限制不应影响本研究结果的可靠性。其次,由于节段神经直接以相同的水平支配神经,因此腰椎多裂肌只在与突出症相同的水平上进行评估。第三,通过临床检查评估单侧神经根病,并且无法获得患者的电诊断检查结果。
总之,单侧腰椎间盘突出症患者的定量测量方法和多裂肌的视觉分级均显示出与腰椎间盘突出症同一侧和同一水平的多裂肌的脂肪浸润增加,并且脂肪肌肉的浸润与症状持续时间和神经压迫的严重程度有关。此外,关于脂肪浸润的肌肉组成的直观而实用的视觉分级与定量测量同样有用。因此,在日常实践中,视觉上评价多裂肌的脂肪浸润可能是优选的,并应包括在报告算法中。
参考文献
[1] Hoy D,March L,Brooks P,et al.The global burden of low back pain:estimates from the Global Burden of Disease 2010 study[J].Ann Rheum Dis,2014,73(6):968-974.
[2] Cooley JR,Walker BF,Ardakani EM,et al.Relationships be-tween paraspinal muscle morphology and neurocompressive con-ditions of the lumbar spine:a systematic review with meta-analy-sis[J].BMC Musculoskelet Disord,2018,19(1):351.
[3] Kong WZ,Goel VK,Gilbertson LG,et al.Effects of muscle dysfunction on lumbar spine mechanics:a finite element study based on a two motion segments model[J].Spine(Phila Pa 1976),1996,21(19):2197-2206.
[4] Franke J,Hesse T,Tournier C,et al.Morphological changes of the multifidus muscle in patients with symptomatic lumbar disc herniation[J].J Neurosurg Spine,2009,11(6):710-714.
[5] Yoshihara K,Shirai Y,Nakayama Y,et al.Histochemical changes in the multif i dus muscle in patients with lumbar inter-vertebral disc herniation[J].Spine(Phila Pa 1976),2001,26(6):622-626.
[6] Hyun JK,Lee JY,Lee SJ,et al.Asymmetric atrophy of multif i dus muscle in patients with unilateral lumbosacral radiculopathy[J].Spine(Phila Pa 1976),2007,32(21):E598-E602.
[7] Kim WH,Lee SH and Lee DY.Changes in the cross-sectional area of multif i dus and psoas in unilateral sciatica caused by lum-bar disc herniation[J].J Korean Neurosurg Soc,2011,50(3):201-204.
[8] Macintosh JE,Valencia F,Bogduk N,et al.The morphology of the human lumbar multifidus[J].Clin Biomech(Bristol,Avon),1986,1(4):196-204.
[9] Sun D,Liu P,Cheng J,et al.Correlation between interverte-bral disc degeneration,paraspinal muscle atrophy,and lumbar facet joints degeneration in patients with lumbar disc herniation.BMC Musculoskelet Disord,2017,18(1):167.
[10] Chon J,Kim HS,Lee JH.Asymmetric atrophy of paraspinal muscles in patients with chronic unilateral lumbar radiculopathy[J].Ann Rehabil Med,2017,41(5):801-807.
[11] Altinkaya N,Cekinmez M.Lumbar multif i dus muscle changes in unilateral lumbar disc herniation using magnetic resonance imaging[J].Skeletal Radiol,2016,45(1):73-77.
[12] Ekin EE,Kurtul Y?ld?z H,Mutlu H.Age and sex-based distri-bution of lumbar multif i dus muscle atrophy and coexistence of disc hernia:an MRI study of 2028 patients[J].Diagn Interv Radiol,2016,22(3):273-276.
[13] Kang JI,Kim SY,Kim JH,et al.The location of multifidus at-rophy in patients with a single level,unilateral lumbar radicu-lopathy[J].Ann Rehabil Med,2013,37(4):498-504.
[14] Campbell WW,Vasconcelos O,Laine FJ.Focal atrophy of the multi f i dus muscle in lumbosacral radiculopathy[J].Muscle Nerve,1998,21(10):1350-1353.
[15] Fortin M,Lazáry À,Varga PP,et al.Paraspinal muscle asym-metry and fat inf i ltration in patients with symptomatic disc herni-ation[J].Eur Spine J,2016,25(5):1452-1459.
[16] Resorlu H,Savas Y,Aylanc N,Gokmen F.Evaluation of para-vertebral muscle atrophy and fatty degeneration in ankylosing spondylitis[J].Mod Rheumatol,2017,27(4):683-687.
[17] Yoshihara K,Nakayama Y,Fujii N,et al.Atrophy of the multif i dus muscle in patientswith lumbar disk herniation:histochemi-caland electromyographic study [J].Orthopedics,2003,26(5):493-495.
[18] Fardon DF,Williams AL,Dohring EJ,et al.Lumbar disc no-menclature:version 2.0:recommendations of the combined task forces of the North American Spine Society,the American Society of Spine Radiology and the American Society of Neurora-diology[J].Spine J,2014,14(11):2525-2545.
[19] Pfirrmann CW,Dora C,Schmid MR,et al.MR image-based grading of lumbar nerve root compromise due to disk herniation:reliability study with surgical correlation[J].Radiology,2004,230(2):583-588.
[20] Goutallier D,Postel JM,Bernageau J,et al.Fatty muscle de-generation in cuff ruptures.Pre-and postoperative evaluation by CT scan[J].Clin Orthop Relat Res,1994,304:78-83.
[21] Sihvonen T,Herno A,Paljärvi L,et al.Local denervation atro-phy of paraspinal muscles in postoperative failed back syndrome[J].Spine(Phila Pa 1976),1993,18(8):575-581.
[22] Le Huec JC,Basso Y,Aunoble S,et al.Influence of facet and posterior muscle degeneration on clinical results of lumbar total disc replacement:two-year follow -up[J].J Spinal Disord Tech,2005,18(3):219-223.
[23] Puustjarvi K,Tammi M,Reinikainen M,et al.Running train-ing alters fiber type composition in spinal muscles[J].Eur Spine,J 1994,3(1):17-21.
[24] Atci IB,Yilmaz H,Samanci MY,et al.The prevalence of lum-bar paraspinal muscle fatty degeneration in patients with modic type I and I/II end plate changes[J].Asian Spine J,2019.doi:10.31616/asj.2018.0333.[Epub ahead of print]
[25] Hodges P,Holm AK,Hansson T,Holm S.Rapid atrophy of the lumbar multif i dus follows experimental disc or nerve root injury[J].Spine(Phila Pa 1976),2006,31(25):2926-2933.
[26] Wan Q,Lin C,Li X,et al.MRI assessment of paraspinal mus-cles in patients with acute and chronic unilateral low back pain[J].Br J Radiol,2015,88(1053):20140546.
[27] Battaglia PJ,Maeda Y,Welk A,et al.Reliability of the Goutal-lier classification in quantifying muscle fatty degeneration in the lumbar multif i dus using magnetic resonance imaging[J].J Ma-nipulative Physiol Ther,2014,37(3):190-197.
[28] Zhi-Jun H,Wen-Bin X,Shuai C,et al.Accuracy of magnetic resonance imaging signal intensity ratio measurements in the evaluation of multifidus muscle injury and atrophy relative to that of histological examinations[J].Spine(Phila Pa 1976),2014,39(10):E623-E629.

