胆管癌、胰腺、十二指肠、胆囊或原发性或继发性肝脏恶性肿瘤引起的胆道梗阻可导致恶性梗阻性黄疸(malignant obstructive jaundice,MOJ)。这些病人大多处于晚期,不适合进行根治性手术。对于这些患者,梗阻性黄疸的缓解可提高生活质量[1,2]。MOJ治疗方案通常分为3 种:外科手术、内镜下胆汁引流术(ERCP)及经皮经肝胆管引流术(PTCD)。胆道引流可作为姑息性化疗的桥梁,提高局部晚期和转移性胰腺癌和晚期胆管癌的生存率[3,4]。但在接受胆道引流的患者中,30天死亡率高达23.1%,且老年患者、男性、有合并症等患者死亡率较高[5]。采取何种引流方式能够使病人获益最大,目前仍尚无定论。本文仅对实施ERCP或PTCD的两组的成功病例资料,比较各自的效果。
1 资料与方法
1.1 一般资料
收集2017年1月至2018年12月我院肝胆胰外科所有行ERCP或PTCD姑息性治疗MOJ病例,共73例纳入研究,按照治疗方式不同分为两组,即ERCP组和PTCD组。ERCP组共36例,男性22例,女性14例,年龄30~87(平均64.56±13.52)岁;胆囊癌9例,肝门部胆管癌7例,壶腹周围癌10例,胰头癌5例,肝癌2例,胃癌2例,直肠癌胰腺转移1例。PTCD组共37例,男性23例,女性14例,年龄 35~86(平均 63.43±12.82)岁;胆囊癌 6例,肝门部胆管癌9例,壶腹周围癌7例,胰头癌6例,肝癌4例,胃癌5例。两组病人在年龄、性别、疾病诊断、梗阻部位、合并基础疾病(高血压、糖尿病、冠心病)、术前各项指标(K+、ALT、TB、Alb、WBC)均无统计学差异(P>0.05)。见表1、表2、表3。
1.2 纳入和排除标准
纳入标准:①经影像学或组织活检证实为原发性或转移性恶性肿瘤引起的胆管狭窄或闭塞,合并肝内外胆管扩张,实验室检查TB在34.2 μmol/L以上,以DB升高为主(DB>TB50%);②术前因病人身体一般状况差或肿瘤晚期等原因评估为无法行外科根治手术治疗,或病人本人拒绝外科手术治疗,术前评估需要进行减黄治疗;③对于部分病人多次行ERCP或PTCD治疗,仅统计第一次入院数据。排除标准:①由其他良性病变导致的梗阻性黄疸病人;②第二次或多次行ERCP或PTCD治疗的病人;③术前评估心肺功能不全、消化道梗阻、碘过敏史等无法行ERCP治疗的病人,及因肝功能衰竭、凝血功能障碍、大量腹水、穿刺路径无法避开大血管或病灶等无法行PTCD治疗的病人。
表1 两组一般资料对比
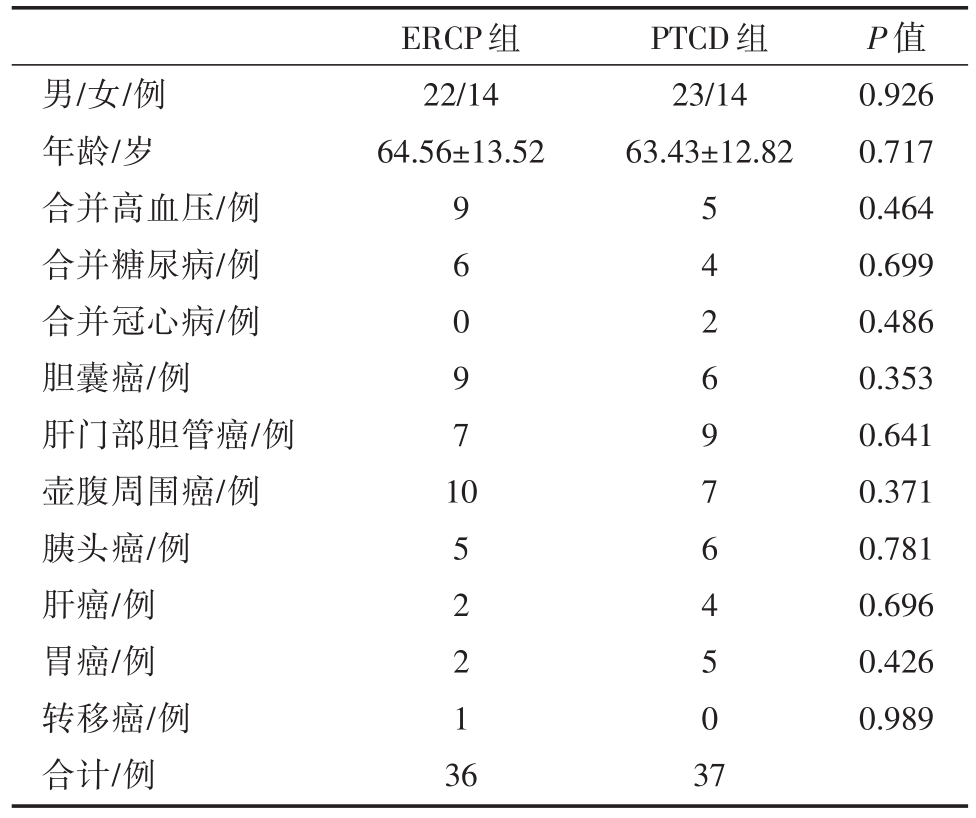
男/女/例年龄/岁合并高血压/例合并糖尿病/例合并冠心病/例胆囊癌/例肝门部胆管癌/例壶腹周围癌/例胰头癌/例肝癌/例胃癌/例转移癌/例合计/例ERCP组22/14 64.56±13.52 PTCD组23/14 63.43±12.82 9 6 0 9 7 1 0 5 2 2 1 3 6 5 4 2 6 9 7 6 4 5 0 3 7 P值0.926 0.717 0.464 0.699 0.486 0.353 0.641 0.371 0.781 0.696 0.426 0.989
表2 两组梗阻部位对比(n)
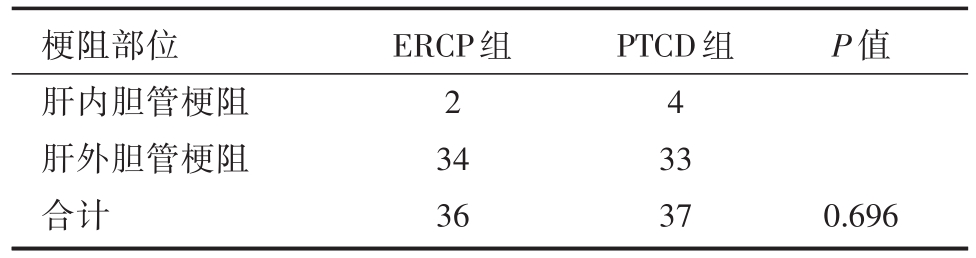
梗阻部位肝内胆管梗阻肝外胆管梗阻合计ERCP组2 34 36 PTCD组4 33 37 P值0.696
表3 两组术前(术前3天)各项指标对比
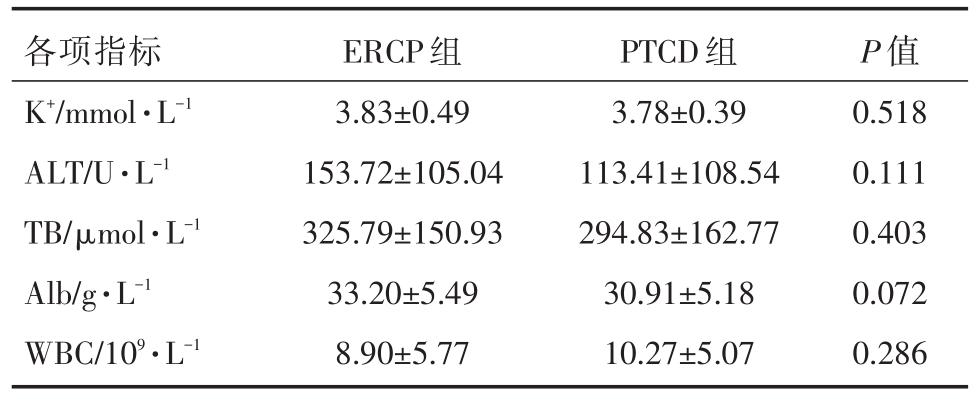
各项指标K+/mmol·L-1 ALT/U·L-1 TB/μmol·L-1 Alb/g·L-1 WBC/109·L-1 ERCP组3.83±0.49 153.72±105.04 325.79±150.93 33.20±5.49 8.90±5.77 PTCD组3.78±0.39 113.41±108.54 294.83±162.77 30.91±5.18 10.27±5.07 P值0.518 0.111 0.403 0.072 0.286
1.4 手术方法
ERCP组:术前禁食8小时,在外科内镜室,配备C型臂X线机及操作平台,检查内镜及相关设备(黄斑马导丝,乳头切开刀,造影导管,机械取石网篮,扩张球囊,取石球囊,止血钛夹,金属、塑料支架,鼻胆管等)。术前30分钟肌注哌替啶注射液100 mg、地西泮注射液10 mg、盐酸消旋山莨菪碱注射液10 mg。病人俯卧位,在心电监护下,十二指肠镜经口、食管、胃,至十二指肠降段,寻找十二指肠乳头,于十二指肠乳头插入造影导管,显影肝外胆管及胰管,所用造影剂为碘海醇注射液。待造影明确梗阻部位后,沿造影导管置入导丝,视具体情况是否需要EST或球囊扩张,沿导丝通过狭窄段,于左右肝管或胆总管内置入支架或留置鼻胆管,完毕后撤镜。
PTCD组:病人仰卧位,常规超声检查,寻找扩张胆管,选取扩张胆管作为穿刺目标,体表定位可穿刺点后,常规消毒铺巾,利多卡因局部逐层麻醉后,11号尖刀片切开皮肤约3 mm,用18G PTC针在超声实时引导下穿刺入扩张的胆管,回抽出胆汁后,抽出针芯,金属导丝沿着PTC针导入胆管内,固定导丝,拔出PTC套管,扩张器括皮后,沿着导丝插入8F引流管,回抽可见胆汁流出,拔出导丝,再次回抽可抽出胆汁,体外缝针固定,接无菌引流袋,穿刺结束。
1.5 术后处理
ERCP组:术后暂禁食水,监测血压、脉搏、低流量吸氧3小时,术后常规使用胰酶抑制药物(1.2 mg奥曲肽24小时持续静脉泵入)、抑酸药物(奥美拉唑等)、护肝、补液等治疗,必要时使用止血药物及合理使用抗生素,手术次日清晨(约06:30)复查血常规、电解质、肝功、血淀粉酶等指标。根据病人状态和检验结果逐步停用以上药物并逐渐恢复饮食,术后定期复查肝功等指标。
PTCD组:术后常规使用护肝、液体支持治疗,注意观察病人胆汁引流情况及腹部体征,手术次日清晨(约06:30)复查血常规、电解质、肝功等指标,合理使用抗生素,定期复查肝功等指标。
1.6 随访及观察指标
一般资料:性别、年龄、疾病诊断、梗阻部位(肝内胆管梗阻、肝外胆管梗阻)、合并基础疾病(高血压、糖尿病、冠心病)。手术成功率、术后并发症、术后住院天数、总住院费用。手术前(术前3天)后(术后5天)各项指标变化,包括K+、ALT、TB、Alb、WBC。
1.7 统计学方法
计数资料以百分比(%)表示,计量资料以均数±标准差表示;采用SPSS 20.0软件进行统计学分析,其中计量资料对比采用t检验,计数资料对比采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组手术成功率对比
ERCP组共36例,手术成功35例,失败1例(该例病人诊断为胃癌转移淋巴结压迫胆总管下段,导丝引导下支架不能够通过狭窄部位,且当时病人状态不佳,所以放弃过多的尝试),手术成功率为97.22%。PTCD组共37例,手术成功33例,4例穿刺失败(其中1例病人诊断为肝门部胆管癌,超声引导下行经皮经肝胆管穿刺,扩张器扩皮后,沿导丝插入引流管,回抽未见胆汁,超声造影显示引流管脱落至皮下软组织,穿刺置管失败;1例病人诊断为肝门部胆管癌伴肝脏广泛转移,穿刺过程中发现肿瘤肝内广泛转移,为避免激惹肿瘤及术后出血可能未强行穿刺置管;1例病人诊断为胃癌伴腹腔广泛转移,因未找到扩张胆管,穿刺置管失败;1例病人诊断为巨块型肝癌,肿瘤广泛压迫胆管,尝试穿刺后未能成功置管),手术成功率为89.19%。见表4。
表4 两组手术成功率对比

P值成功/例失败/例成功率ERCP组35 1 97.22%PTCD组33 4 89.19%0.371
2.2 两组手术前后各项指标(K+、ALT、TB、Alb、WBC)变化情况对比
ERCP组手术成功35例,PTCD组手术成功33例,两组术后ALT、TB指标均有不同程度下降,差异具有统计学意义(P<0.05)。两组手术前后ALT指标下降程度,差异无统计学意义(P>0.05)。而ERCP组术后TB指标下降程度较PTCD组更加明显,差异有统计学意义(P<0.05)。PTCD组手术前后Alb无明显变化,差异无统计学意义(P>0.05);ERCP组术后出现Alb降低,差异有统计学意义(P<0.05)。两组手术前后K+、WBC指标无显著变化,差异无统计学意义(P>0.05)。见表5、表6、表7。
表5 ERCP组手术前后各项指标对比

ERCP组(35例)K+/mmol·L-1 ALT/U·L-1 TB/μmol·L-1 Alb/g·L-1 WBC/109·L-1术前(3天)3.83±0.49 153.72±105.04 325.79±150.93 33.20±5.49 8.90±5.77术后(5天)3.84±0.64 84.11±69.13 168.14±101.20 31.23±3.88 8.96±4.30 P值0.920 0.000 0.000 0.042 0.912
表6 PTCD组手术前后各项指标对比

PTCD组(33例)K+/mmol·L-1 ALT/U·L-1 TB/μmol·L-1 Alb/g·L-1 WBC/109·L-1术前(3天)3.78±0.39 113.41±108.54 294.83±162.77 30.91±5.18 10.27±5.07术后(5天)3.83±0.49 58.62±36.62 219.77±153.88 31.89±4.53 10.97±7.86 P值0.447 0.001 0.005 0.340 0.569
表7 两组手术前(术前3天)后(术后5天)肝功能变化差值及减黄效果对比
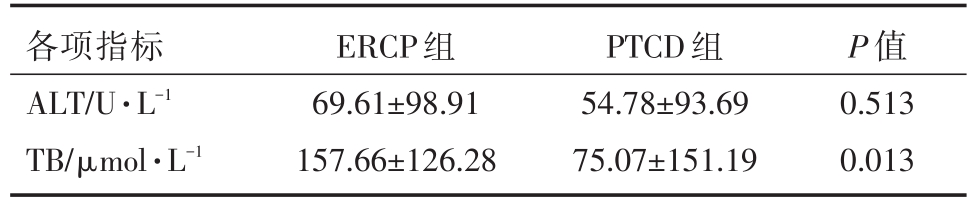
各项指标ALT/U·L-1 TB/μmol·L-1 ERCP组69.61±98.91 157.66±126.28 PTCD组54.78±93.69 75.07±151.19 P值0.513 0.013
2.3 两组术后并发症对比
ERCP组手术成功35例,术后一周内出现并发症共6例,发生率为17.14%。PTCD组手术成功33例,术后一周内出现并发症共9例,发生率为27.27%。两组术后并发症发生率之间无统计学差异(P>0.05)。见表8。
表8 两组术后并发症对比

并发症/例高淀粉酶血症电解质紊乱堵塞致引流不畅胆系感染导管脱位胆漏肝性脑病合计发生率ERCP组PTCD组P值5 1 0 0 0 0 0 6 0 0 3 3 1 1 1 9 0.314 17.14%27.27%
2.4 两组术后住院天数及总住院费用对比
ERCP组术后住院天数平均值为7.25天,PTCD组术后住院天数平均值为17.73天,两组间有统计学差异(P<0.05)。ERCP组总住院费用平均值为50970.70元,PTCD组总住院费用平均值为61034.17元,两组间无统计学差异(P>0.05)。见表9。
表9 两组术后住院天数及住院费用对比

术后住院天数/天总住院费用/元ERCP组7.25±4.41 50970.70±21955.17 PTCD组17.73±15.91 61034.17±87976.08 P值0.000 0.504
3 讨论
本组病例中,两组手术前后ALT、TB指标进行对比,均有不同程度下降,表明两种治疗方法都可以改善肝功能、减轻黄疸,是MOJ姑息性治疗的有效手段。ERCP组手术前后TB指标变化值较PTCD组更加显著,表明ERCP减黄(降低血中胆红素)效果更佳,且可以显著降低病人术后住院天数。总体结果符合文献报道[6-8]。
先前的临床研究已表明,胆道引流可以改善患者免疫功能和营养状况,降低感染风险[9],但术后并发症的风险增加[10];术前胆道引流并没有降低死亡率反而增加并发症[11,12],但最终还是有许多患者接受了某种胆道引流手术[13]。至少作为一种暂时性的措施,可以缓解等待手术的病人的黄疸和内镜后逆行胰胆管造影预防性放置胆道支架以预防胆管炎[8]。因此,对于恶性梗阻性黄疸的胆道引流尚存在不同意见。
本次研究中,ERCP与PTCD两组手术成功率均较高,无统计学差异。一般而言,ERCP操作过程中十二指肠镜顺利插管进入十二指肠乳头是ERCP手术成功的关键,如果肿瘤侵犯十二指肠乳头、胆总管下段肿瘤广泛浸润性生长、胆肠吻合术后等导致胆道结构改变,甚至造成完全梗阻,可增加术中导丝插入的难度;其次,位置比较高的胆管癌或胆囊癌侵犯肝门,ERCP下导管、导丝不能进入肝内胆管,支架植入更加困难,可导致手术失败或仅能行一侧肝管支架引流,影响术后减黄效果。PTCD操作过程中,是否能够顺利穿刺进入扩张的胆管是影响PTCD手术成功的关键,对于PTCD穿刺置管失败的病人可尝试行ERCP,或让更加有经验的医生操作。
ERCP术后,急性胰腺炎、胆系感染、胆道出血、支架堵塞、移位或支架导致的肠道损伤等是常见并发症。其中,急性胰腺炎最为常见,原因主要有胰腺本身疾病、胆管狭窄、胰管汇流异常、反复插管、造影剂注入胰管过快、术中使用EST或乳头球囊扩张方法不对等。总结相关文献,ERCP术后有效预防急性胰腺炎措施包括避免术中反复插管及暴力操作;避免术中快速过量注入造影剂;减少局部热损伤;尽量使用较大型号球囊扩张器;减少手术操作时间。PTCD术后,胆道出血、胆系感染、胆漏、引流管/支架脱位或堵塞等是常见并发症。本次研究中可见引流不畅及胆系感染最为常见,胆系感染也往往与术后引流不畅相关。此时,首先应该明确堵塞原因,根据实际情况行引流管冲洗、导丝疏通、调整引流管位置或经原窦道置入导丝并再次置管。避免胆系感染有效措施是保持有效引流使用有效抗生素。
目前,对于MOJ姑息性治疗,究竟采取何种引流方式能够使病人获益最大,仍尚无定论。部分研究表明[7],ERCP可作为MOJ姑息性治疗的首选,只有不具备ERCP条件或因梗阻部位不能够行ERBD或EMBE时再选择PTCD。近年来,内镜超声引导下胆道引流术(EUS-BD)的情况应用于治疗恶性梗阻性黄疸在ERCP失败的取代方法被越来越多的使用并逐渐成为首选的干预措施[14]。本人认为,ERCP与PTCD两种治疗方案相辅相成,应该根据病人具体情况、医院诊疗条件等因素制定个体化治疗方案,包括PTCD联合ERCP治疗中晚期MOJ。
参考文献
[1] Saluja SS,Gulati M,Garg PK,et al.Endoscopic or percutane-ous biliary drainage for gallblad der cancer:a randomized trial and quality of life assessment[J].Clin Gastroenterol Heptol,2008,6(8):944-950.e3.
[2] Zhao XQ,Dong JH,Jiang K,et al.Comparison of percutane-ous transhepatic biliary drainage and endoscopic biliary drain-age in the management of malignant biliary tract obstruction:a meta-analysis[J].Dig Endosc,2015,27(1):137-145.
[3] Valle J,Wasan H,Palmer DH,et al.Cisplatin plus gemcitabi-ne versus gemcitabine for biliary tract cancer[J].N Engl J Med,2010,362(14):1273-1281.
[4] Valle JW,Wasan H,Johnson P,et al.Gemcitabine alone or in combination with cisplatin in patients with advanced or metastat-ic cholangiocarcinomas or other biliary tract tumours:a multi-centre randomised phase II study -The UK ABC-01 Study[J].Br J Cancer,2009,101(4):621-627.
[5] Rees J,Mytton J,Evison F,et al.The outcomes of biliary drain-age by percutaneous transhepatic cholangiography for the pallia-tion of malignant biliary obstruction in England between 2001 and 2014:a retrospective cohort study[J].BMJ Open,2020,10(1):e033576.
[6] 高超,王德海,刘恩宇,等.硅胶管搭桥内引流治疗恶性肿瘤致阻塞性黄疸106例分析[J].岭南现代临床外科,2001,1(3):143-145.
[7] Jain S,Kataria T,Bisht SS,et al.Malignant obstructive jaun-dice -brachytherapy as a tool for palliation[J].J Contemp Brachytherapy,2013,5(2):83-88.
[8] Moole H,Bechtold M,Puli SR.Efficacy of preoperative biliary drainage in malignant obstructive jaundice:a meta-analysis and systematic review[J].World J Surg Oncol,2016,14(1):182.
[9] Roughneen PT,Gouma DJ,Kulkarni AD,et al.Impaired spe-cific cell-mediated immunity in experimental biliary obstruction and its reversibility by internal biliary drainage[J].J Surg Res,1986,41(2):113-125.
[10] Greig JD,Krukowski ZH,Matheson NA.Surgical morbidity and mortality in one hundred and twenty-nine patients with ob-structive jaundice[J].Br J Surg,1988,75(3):216-2169.
[11] Fang Y,Gurusamy KS,Wang Q,et al.Meta-analysis of ran-domized clinical trials on safety and efficacy of biliary drainage before surgery for obstructive jaundice[J].Br J Surg,2013,100(12):1589-1596.
[12] Sewnath ME,Karsten TM,Prins MH,et al.A meta-analysis on the efficacy of preoperative biliary drainage for tumors causing obstructive jaundice[J].Ann Surg,2002,236(1):17-27.
[13] Lillemoe KD.Preoperative biliary drainage and surgical out-come[J].Ann Surg,1999,230(2):143-144.
[14] Sassatelli R,Cecinato P,Lupo M,et al.Endoscopic ultrasound-guided biliary drainage for malignant biliary obstruction after failed ERCP in low performance status patients[J].Dig Liver Dis,2020,52(1):57-63.

