孤立性纤维性肿瘤(solitary fibrous tumor,SFT)是一种较少见的间叶来源的肿瘤。最初由Klemperer和Rabin于1931年首次报道,被认为来源于胸膜间皮细胞,现认为起源于一种CD34+的树突状间叶细胞,可发生于任何部位,如胸膜、腹膜、脑膜、椎管、口鼻腔、眼眶、支气管、胃肠道、膀胱、前列腺等[1,2]。由于其组织学的复杂性和多样性,发生部位广泛,较少见且往往缺乏对该病的认识,临床上极易与其他肿瘤相混淆[2]。现就我院过去7年半收治的60例SFT患者的临床资料,并结合国内外研究报道,总结并探讨SFT的流行病学特点、临床病理学特征、诊断、治疗和随访。
1 临床资料
1.1 一般资料
收集我院2012年1月至2019年6月,经手术切除、病理及IHC明确诊断孤立性纤维性肿瘤,排除穿刺标本、未经IHC明确诊断、外院会诊等病例,共收集60例SFT患者的临床资料。其中男26例,女34例,年龄10月龄~70岁,中位年龄46岁。所有病例均行手术切除,手术切除标本经10%福尔马林固定,石蜡包埋、常规切片,行HE染色和免疫组化染色以明确诊断。
1.2 临床表现
本组病例多为出现专科症状(34/60=56.7%),如头晕头痛、视物模糊、一侧肢体乏力、一侧耳疼、鼻腔出血、鼻塞、腹痛腹胀、咳嗽咳痰等,进一步检查发现的。23.3%的病例为体检时意外发现。另外20%病例自行发现或扪及包块而就诊。
1.3 诊断和治疗
所有病例的肿瘤均行手术切除,肿瘤部位:盆腹腔11例,其中腹膜后4例;肝脏4例,肾1例,前列腺1例;甲状腺1例,躯干、四肢9例;耳鼻喉、口腔10例;肺、纵膈6例;颅内14例,椎管内3例。除颅内、椎管内肿瘤为分块切除外,大多为整块切除。术后均行病理检查和免疫组化染色检查,由2名病理科医师共同确诊为孤立性纤维性肿瘤。
2 结果
2.1 病理检查
2.1.1 大体检查 肿瘤最大37.5 cm×22 cm×11 cm,最小 0.6 cm×0.5 cm×0.4 cm,中位直径约 5 cm。大部分肿瘤界限较清楚,可见到部分或完整包膜;肿瘤切面多为灰白色、灰黄色,少数为灰褐色;质韧或稍硬,多为实性,少数可见胶冻状、小囊性改变,偶可见坏死及浸润周围组织。
2.1.2 镜检 肿瘤细胞多呈梭形、短梭形或卵圆形。多数无明显异型性,少数为轻度异型性,极少数亦可表现为异型性明显。核分裂像多为罕见、偶见或少见,极少数核分裂像可达10~15个/10HPF。肿瘤细胞多呈细胞稀疏区与细胞致密区交替排列,表现为束状、席纹状、血管外皮瘤样或不规则排列;间质中可见粗大的胶原纤维,常伴有玻璃样变性;肿瘤组织内可见较多血管。
2.2 免疫组化染色
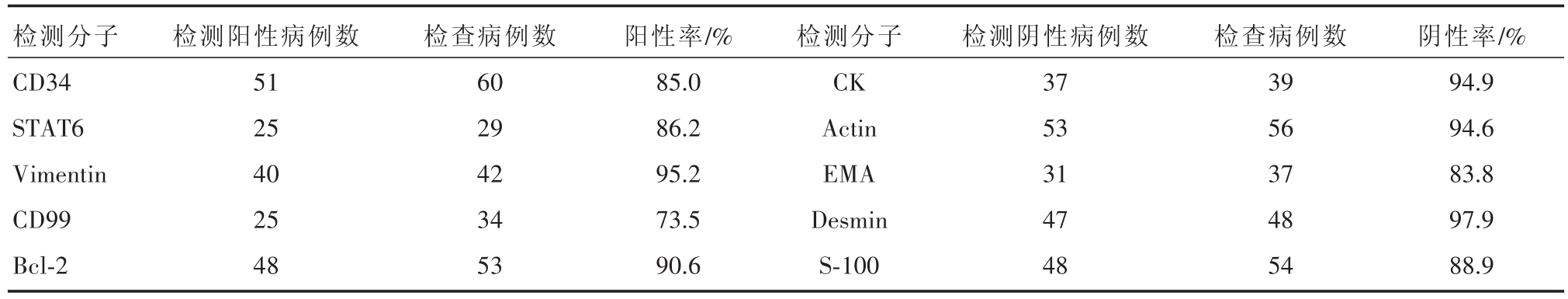
除组织学形态外,IHC染色对SFT的确诊至关重要。CD34、STAT6、Bcl-2、CD99、Vimentin和CK、Actin、Desmin、S-100、EMA是诊断SFT常用的分子标志物。其检查情况详见表1。
2.3 随访
60例病例中有27例进行术后复查随访。随访最短1个月,最长90个月,平均随访半年。27例中有4例在复查随访时发现复发。
3 讨 论
SFT多发生于成年的各个年龄段,平均发病年龄50岁,无明显性别差异[3]。本组病例中位年龄46岁,男女比例无明显差异,与之报道相一致。值得一提的是,本组病例中最小年龄为10月龄,尚未见更低年龄病例报道。研究报道[4]胸腔为最常见SFT肿瘤发病部位,其次为腹腔,约30%出现在胸膜以外的部位。我中心报道与此差异较大,胸腔SFT肿瘤仅占10%(6/60),盆腹腔(25%)为最常见部位,其次为颅内(23%)、耳鼻喉口腔(17%),这可能与东西方人种差异有关。Brian Davanzo等[5]学者认为大多SFT肿瘤患者无症状或者为非特异性症状,通常进行影像学检查时偶然发现,与我中心的数据存在差异。我们的数据显示约56%患者出现专科症状,如头晕头痛、视物模糊、一侧肢体乏力、鼻塞、腹痛腹胀等,另外44%患者为体检意外发现或者自行扪及包块。这可能与发病部位不同有关。
SFT 肿瘤病理组织学特点[1,2]如下:①大体病理:多为界限清楚的肿块,多为孤立性,部分有纤维性假包膜,可呈分叶状或哑铃状;肿瘤切面多呈灰白或淡褐色,质韧,少数可呈黏液样,或出血及囊性病变;②组织学:梭形或短梭形肿瘤细胞呈束状、席纹状、血管外皮瘤样或不规则排列,细胞丰富区域和细胞稀疏区域相间分布,间质中可见粗大的胶原纤维,常伴有玻璃样变性。SFT的确诊主要依赖病理组织学和免疫组织化学染色。其中恶性较少见,约占10%~15%。多位学者提出了恶性SFT的肿瘤特征标准,更广为接受的为England等[6]学者提出:①肿瘤大于10 cm;②肿瘤坏死或出血;③细胞多形性;④核分裂像增多,≥4/10 HPF。本组病例有14例考虑恶性SFT,恶性率为23%,稍高于一般所报道的10%~15%[4]。免疫组化染色有助于诊断和鉴别诊断。肿瘤细胞常表达CD34、STAT6、Vimentin、CD99和 Bcl-2,而结蛋白(Desmin)、细胞角蛋白(CK)、EMA、Actin、S-100、CD68、CD117一般呈阴性。其中CD34和STAT6对SFT的诊断意义重大,CD34弥漫强阳表达、STAT6核强阳表达是SFT的免疫表型特点之一。然而,CD34表达缺乏特异性,在一些其他间叶源性肿瘤如胃肠道间质瘤(GIST)亦可表达,可通过CD117和DOG1分子标志物加以鉴别[7]。本研究中CD34阳性率为85.0%(51/60),STAT6阳性率为86.2%(25/29)。Vimentin(95.2%)、CD99(73.5%)和Bcl-2(90.6%)也有助于诊断。SFT分子遗传学重大进展之一就是NAB2-STAT6基因融合被证实对SFT诊断具有高度敏感性和特异性[8]。由于需要设计特殊的引物探针,且需要基因二代测序仪,成本较高。STAT6核强阳表达可作为一种替代工具来辅助证实存在NAB2-STAT6融合基因,同样可以可靠地将SFT与其他软组织肿瘤等鉴别[9]。免疫组化染色有助于本病与以下几种疾病鉴别[10]:神经鞘瘤、神经纤维瘤、恶性间皮瘤、滑膜肉瘤、胃肠道间质瘤等。
表1 各分子标志物在孤立性纤维性肿瘤中的表达
检测分子CD34 STAT6 Vimentin CD99 Bcl-2检测阳性病例数51 25 40 25 48检查病例数60 29 42 34 53阳性率/%85.0 86.2 95.2 73.5 90.6检测分子CK Actin EMA Desmin S-100检测阴性病例数37 53 31 47 48检查病例数39 56 37 48 54阴性率/%94.9 94.6 83.8 97.9 88.9
由于难以设计随机对照试验,目前尚未制定针对SFT的全球公认的治疗策略。手术完整切除肿瘤即获得足够的阴性切缘,为SFT最主要的治疗手段。能否彻底清除肿瘤是预防SFT复发的关键。对于腹膜后孤立性纤维性肿瘤,由于腹膜后巨大潜在间隙,便于肿瘤膨胀性生长,同时往往具有丰富的血供,有多支扩张血管进入,肿瘤可能与邻近重要血管粘连或将其包绕,因此手术难度大的关键在于术中控制大出血[11]。放疗并不推荐用于肿瘤得到完整切除的病例。多个回顾性研究评估了以阿霉素为基础的化疗方案疗效不佳,因而更多的研究转向靶向治疗[5]。研究显示[12]替莫唑胺和贝伐单抗有79%部分缓解率。此外,多靶点抗血管生成药物如舒尼替尼也显示出抗SFT效果。
由于SFT有部分表现为恶性,且良性SFT也有恶变可能,因此长期随访十分重要[13]。一般建议术后3年内每3~6个月随访1次,以后每年复查1次。本研究中,60例病例有27例(45%)进行术后复查随访,且大多在术后1年内随访1~2次便不再随访。因此,大多数医护人员和患者对本病的认识还有待提高。
参考文献
[1] Demicco EG,Park MS,Araujo DM,et al.Solitary fibrous tumor:a clinicopathological study of 110 cases and proposed risk assessment model[J].Mod Pathol,2012,25(9):1298-1306.
[2] Thway K,Ng W,Noujaim J,et al.The Current Status of Solitary Fibrous Tumor:Diagnostic Features,Variants,and Genetics[J].Int JSurg Pathol,2016,24(4):281-292.
[3] Suehisa H,Yamashita M,Komori E,et al.Solitary fibrous tumor of the mediastinum[J].Gen Thorac Cardiovasc Surg,2010,58(4):205-208.
[4] Gold JS,Antonescu CR,Hajdu C,et al.Clinicopathologic correlates of solitary fibrous tumors[J].Cancer,2002,94(4):1057-1068.
[5] Davanzo B,Emerson RE,Lisy M,et al.Solitary fibrous tumor[J].Transl Gastroenterol Hepatol,2018,3:94.
[6] England DM,Hochholzer L,Mccarthy MJ.Localized benign and malignant fibrous tumors of the pleura.A clinicopathologic review of 223 cases[J].Am JSurg Pathol,1989,13(8):640-658.
[7] Miettinen M,Felisiak-Golabek A,Wang Z,et al.GIST manifesting as a retroperitoneal tumor:clinicopathologic immunohistochemical,and molecular genetic study of 112 cases[J].Am J Surg Pathol,2017,41(5):577-585.
[8] Robinson DR,Wu YM,Kalyana-Sundaram S,et al.Identification of recurrent NAB2-STAT6 gene fusions in solitary fibrous tumor by integrative sequencing[J].Nat Genet,2013,45(2):180-185.
[9] Cheah AL,Billings SD,Goldblum JR,et al.STAT6 rabbit monoclonal antibody is a robust diagnostic tool for the distinction of solitary fibrous tumour from its mimics[J].Pathology,2014,46(5):389-395.
[10]高杰,汪欣,尹洪芳,等.盆腔孤立性纤维性肿瘤的诊断及治疗[J].北京大学学报(医学版),2013,45(6):960-964.
[11]艾中立.腹膜后肿块的临床特征[J].腹部外科,2002,15(4):200-201.
[12]Park MS,Patel SR,Ludwig JA,et al.Activity of temozolomide and bevacizumab in the treatment of locally advanced,recurrent,and metastatic hemangiopericytoma and malignant solitary fibrous tumor[J].Cancer,2011,117(21):4939-4947.
[13]朱磊,林琳,郭大伟,等.孤立性纤维性肿瘤的诊断及外科治疗[J].中国普外基础与临床杂志,2012,19(1):99-101.

