

岭南现代临床外科 ›› 2020, Vol. 20 ›› Issue (02): 139-145.DOI: 10.3969/j.issn.1009-976X.2020.02.002
摘要:
肾癌又称肾细胞癌(renal cell carcinoma,RCC),是泌尿系统常见恶性肿瘤之一,在美国约占4%新发肿瘤病例和2.4%的肿瘤死亡病例[1]。RCC起源于肾小管上皮细胞,约占肾恶性肿瘤的85%~90%[2],而肾透明细胞癌(clear cell Renal Cell Carcinoma,ccRCC)为肾癌最常见的病理类型,约占75%[3]。20%~25%的肾癌患者在诊断时便已发生远处转移[4]。肾癌对放化疗均不敏感,手术切除是治疗局限性肾癌和局部进展性肾癌的主要方法,但近30%的肾癌患者在术后出现复发和转移[5],因此寻找对诊断和治疗ccRCC有重要作用的新的生物标志物和治疗靶点具有重要意义。
研究表明,环状RNA(circular RNA,circRNA)在肿瘤的发生、发展中发挥至关重要的作用[6],但其具体作用机制仍有待探索。circRNA是一类由首尾共价闭合形成的环状RNA分子[7],它可通过作为 miRNA sponge[8]、与蛋白质相互作用[9]、编码基因[10]或调控基因转录[11]等方式发挥作用,但circRNA在肾癌中的研究尚少,有待深入研究。本研究基于GEO数据库肾透明细胞癌与癌旁组织circRNA芯片结果,探讨circDOCK4在ccRCC中的表达及其生物学功能,研究circDOCK4对ccRCC细胞增殖、迁移和侵袭能力的影响。
20对未接受药物治疗的肾透明细胞癌组织及癌旁组织均来自于中山大学孙逸仙纪念医院2017年至2019年肾透明细胞癌患者的手术标本。所有患者均签署知情同意书,手术标本均经过病理学检查确证,冻于液氮后置于-80℃保存。患者的临床资料和标本的收集受到中山大学孙逸仙纪念医院伦理委员会的授权和监督。
人源肾透明细胞癌细胞系ACHN、Caki-1和正常肾小管上皮细胞系HK-2购自ATCC。ACHN用1640培养基培养,Caki-1用MCCOYS 5A培养基培养,HK-2用DMEM/F12培养基培养。所有细胞系均用含10%FBS和1%青霉素及链霉素的完全培养基置于含5%CO2的37℃培养箱中培养。
取对数期生长的细胞消化后按1×105细胞种板于六孔板中,置于含5%CO2的37℃培养箱中培养,次日使用 Lipofectamine RNAiMAX(Invitrogen)将siRNAs转染至细胞中,培养48小时后收取细胞进行后续试验。
按照说明书推荐方法使用RNAiso Plus(TaKa-Ra)提取细胞及组织总RNA,使用PrimeScript RT Reagent Kit(TaKaRa)逆转录合成 cDNA,然后使用 SYBR Premix Ex TagⅡ(TaKaRa)在 Roche LightCycler 480ⅡPCR仪上进行qRT-PCR检测,以GAPDH作为内参基因,RNA 相对水平使用2-ΔΔCt方法分析。引物如下:circDOCK-F:5′-GCTCATCGTGCATAAGGTGAA-3′;circDOCK-R:5′-TGGTACTCACTGGCTGGT-3′;DOCK mRNA-F:5′-GGCCTGTCATTGGAAATTGGA-3′;DOCK mRNA-R:5′-GTGAACGTAGCTGGAAGGAAA-3′。
提取细胞总RNA后,以6 U RNase R(20 U·μl-1,Epicentre Technologies)与 2 mg RNA混匀,对照组则将等量DEPC水与2 mg RNA混匀,37℃孵育15 min,然后使用PrimeScript RT Reagent Kit(Ta-KaRa)逆转录试剂合成cDNA。
将细胞cDNA和gDNA PCR产物使用TAE缓冲液在2%琼脂糖胶中进行水平电泳,使用120 V电泳30 min以分离DNA,使用Super DNA Marker(CWBIO)作为DNA marker,电泳结束后将琼脂糖胶置于凝胶成像系统(Tanon)下进行成像。
将转染siRNAs 48 h后的细胞以1000细胞种板于96孔板中,细胞增殖能力通过MTS进行检测。使用100 μL 20%MTS 37℃孵育2 h后,利用吸收光酶标仪(CMAX PLUS)在波长为490 nm处读取吸光值,连续检测6天。
取转染siRNAs 48 h后的细胞按1.5×104细胞种板于96孔板,按照说明书使用Cell-LightTM EdU Apollo488试剂盒(RiboBio)检测细胞增殖能力,置于倒置荧光显微镜(OLYMPUS)下随机选取三个视野进行拍照,以EdU+细胞与Hoechst+细胞的比值计算各组细胞增殖能力。
将转染siRNAs 48 h后的细胞以1000细胞种板于六孔板中,置于培养箱中培养7~10天。取出后用PBS清洗一遍细胞后使用4%多聚甲醛室温固定20 min,再用0.5%结晶紫溶液室温染色15 min,最后使用相机摄影后对细胞克隆团分别进行计数。
将转染siRNAs 48 h后的细胞用无血清培养基重悬,并将200 μL 1×105细胞加入24孔Transwell迁移小室的上室中,下室提前加入600 μL含10%FBS的完全培养基,置于培养箱培养3 h(ACHN)或5 h(Caki-1)后,使用棉签将小室上层细胞轻轻刮去,迁移至小室的下室面的细胞使用4%多聚甲醛固定和0.5%结晶紫溶液进行染色,然后通过正置显微镜(Nikon)随机选取三个视野拍照并进行计数。
将转染siRNAs 48 h后的细胞种板于12孔板中,置于培养箱中培养至细胞密度达到90%后使用200 μL枪头在12孔板孔中间划一条直线,在0 h、13 h或17 h分别于倒置显微镜(OLYMPUS)下选取三个不同的视野进行拍照。
使用PARISTMKit(Ambion)按照推荐操作方法将收集好的3×106细胞分别用300 μl预冷的Cell Fractionation Buffer裂解,500×g、4℃离心3分钟后,轻柔吸取上清液转移至新管中即为胞质裂解产物,沉淀物即为细胞核,使用200 μL Cell Disruption Buffer重悬,剧烈震荡后得到细胞核裂解产物,然后分别过柱提取RNA。
利用SPSS 20.0和GraphPad Prism 7.0对数据进行统计分析和作图。两组间的比较采用独立样本t检验,数据以均数±标准差表示,P<0.05表示差异有统计学意义。
通过对来自GSE100186数据集四对肾透明细胞癌及癌旁组织circRNA芯片的再分析,发现hsa_circ_0081979在肾透明细胞癌组织中显著升高。根据circBase显示,hsa_circ_0081979由DOCK4基因的外显子14、15、16首尾相接共价闭合而成,全长395 nt,故命名为circDOCK4。
首先我们在收集的20对ccRCC组织及癌旁组织中检测circDOCK4的表达水平,qRT-PCR结果显示,ccRCC组织circDOCK4表达水平明显高于癌旁组织(图1A)。同时,与永生化肾小管上皮细胞系HK-2相比,ccRCC细胞系ACHN和Caki-1中circ-DOCK4表达水平明显升高(图1B)。

图1 circDOCK4在ccRCC组织和细胞系的表达 A.检测circDOCK4在20对ccRCC组织和癌旁组织的表达水平;B.检测circ-DOCK4在ccRCC细胞系ACHN、Caki-1和正常肾小管上皮细胞系HK-2的表达水平(*P<0.05,***P<0.001)
为了验证circDOCK4的成环性,我们设计了针对circDOCK4接口处的环性引物和针对DOCK4 mRNA的线性引物,并对ACHN和Caki-1细胞反转录产物cDNA和基因组gDNA进行PCR扩增,然后对PCR产物进行核酸凝胶电泳。如图2A显示,DOCK4 mRNA的线性引物能同时扩增细胞的cDNA和gDNA,而circDOCK4环性引物只能扩增细胞的cDNA而不能扩增gDNA。
此外我们利用RNase R消化由ACHN和Caki-1细胞提取的RNA,结果表明,线性引物扩增产物DOCK4 mRNA水平在RNase R消化后显著降低,然而circDOCK4在RNase R消化后水平无明显改变,表明circDOCK4在一定程度上能够抵抗RNase R的消化(图2B)。
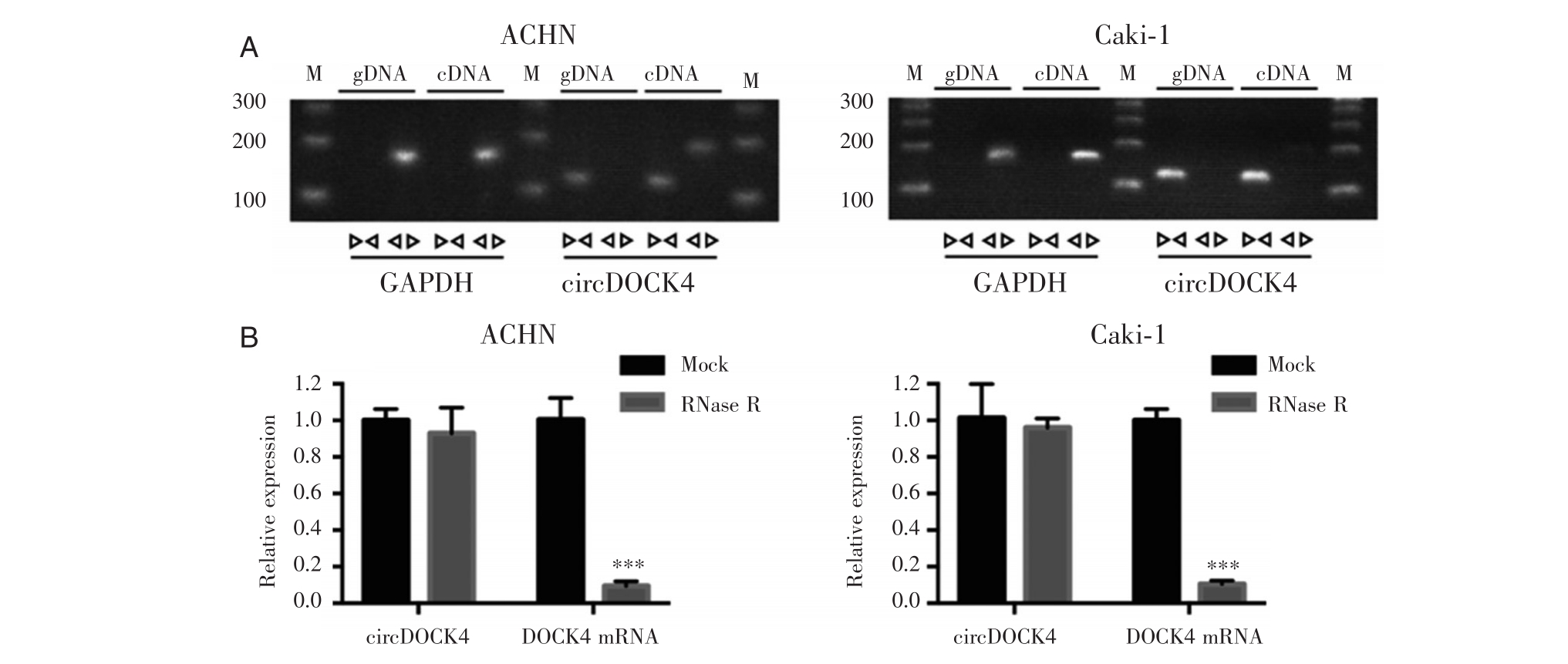
图2 circDOCK4的成环性验证 A.以cDNA、gDNA为模板,分别用circDOCK4的线性引物和环状引物PCR扩增后进行核酸凝胶电泳,GAPDH为内参;B.利用RNase R消化由ACHN和Caki-1细胞提取的RNA,再分别检测circDOCK4和DOCK4 mRNA的水平(***P<0.001)
为了研究circDOCK4对ccRCC细胞生物学功能的影响,我们首先向ACHN和Caki-1细胞分别转染 circDOCK4的siRNAs,利用 qRT-PCR检测circDOCK4在各转染细胞中表达水平的改变,计算其敲降效率。如图3A所示,与si#NC相比,si#1和si#2能显著降低circDOCK4水平,但是对DOCK4 mRNA水平无明显影响。
向ACHN和Caki-1细胞转染circDOCK4的siRNAs后,通过MTS、EdU和克隆形成实验检测ACHN和Caki-1细胞的增殖能力。EdU实验结果显示,细胞转染了circDOCK4 si#1和si#2后,EdU+细胞与Hoechst+细胞比值显著低于si#NC组(图3B)。克隆形成实验结果显示,si#1和si#2组细胞克隆数目低于si#NC组(图4C)。MTS实验结果显示,通过连续6天检测OD值,si#1和si#2组细胞增殖曲线明显低于si#NC组(图4D)。以上结果表明,沉默circDOCK4能显著抑制ccRCC细胞的增殖能力。
为了研究circDOCK4对ccRCC细胞迁移能力的影响,通过向ACHN和Caki-1细胞转染siRNAs,利用Transwell小室迁移实验,统计结果显示,与si#NC组相比,si#1和si#2组细胞迁移至下室面的细胞数量明显减少(图3E)。而划痕愈合实验也表明,细胞转染了circDOCK4的si#1和si#2后,细胞迁移距离小于si#NC组(图3F)。结合以上,这些结果表明沉默circDOCK4能明显抑制ccRCC细胞的迁移和侵袭能力。
通过对ACHN和Caki-1细胞进行核浆分离以鉴定circDOCK4的细胞亚定位。18S rRNA作为细胞浆定位的内参基因,U6作为细胞核定位的内参基因。结果显示(图6),circDOCK4在细胞浆水平显著高于细胞核水平,表明其主要定位于细胞浆,猜测circDOCK4可能在胞浆通过作为海绵吸附miRNA而发挥重要作用。
1976年,circRNA首次发现于类病毒中,而当时研究者普遍认为这是转录本错误剪接的产物[12,13],因而忽视了其生物学功能,直到2012年Salzman等[14]通过RNA测序发现circRNA广泛存在于人类体细胞中,circRNA才逐渐成为研究热点。
circRNA是一类丰富而稳定、具有高度保守性和时空特异性的内源性非编码RNA[15-17]。过去几年间,越来越多的circRNA被报道在多种癌种中发挥着重要的促癌或抑癌功能[18],circRNA对肿瘤细胞的增殖和转移具有重要的影响。ZhangX等[19]通过RNA测序发现circNRIP1在胃癌中显著高表达,并且能够通过吸附miR-149-5p进而上调AKT1/mTOR分子通路促进胃癌增殖和转移。LiuHW等[20]通过细胞侵袭模型发现circFNDC3B在膀胱癌中显着下调且能通过miR-1178-3p-G3BP2-SRC/FAK信号传导途径抑制膀胱癌体内外增殖、迁移和侵袭能力。FengY等[21]发现has_circ_0005276能够通过FUS结合蛋白转录激活XIAP,从而促进前列腺癌的增殖、迁移以及EMT转化。

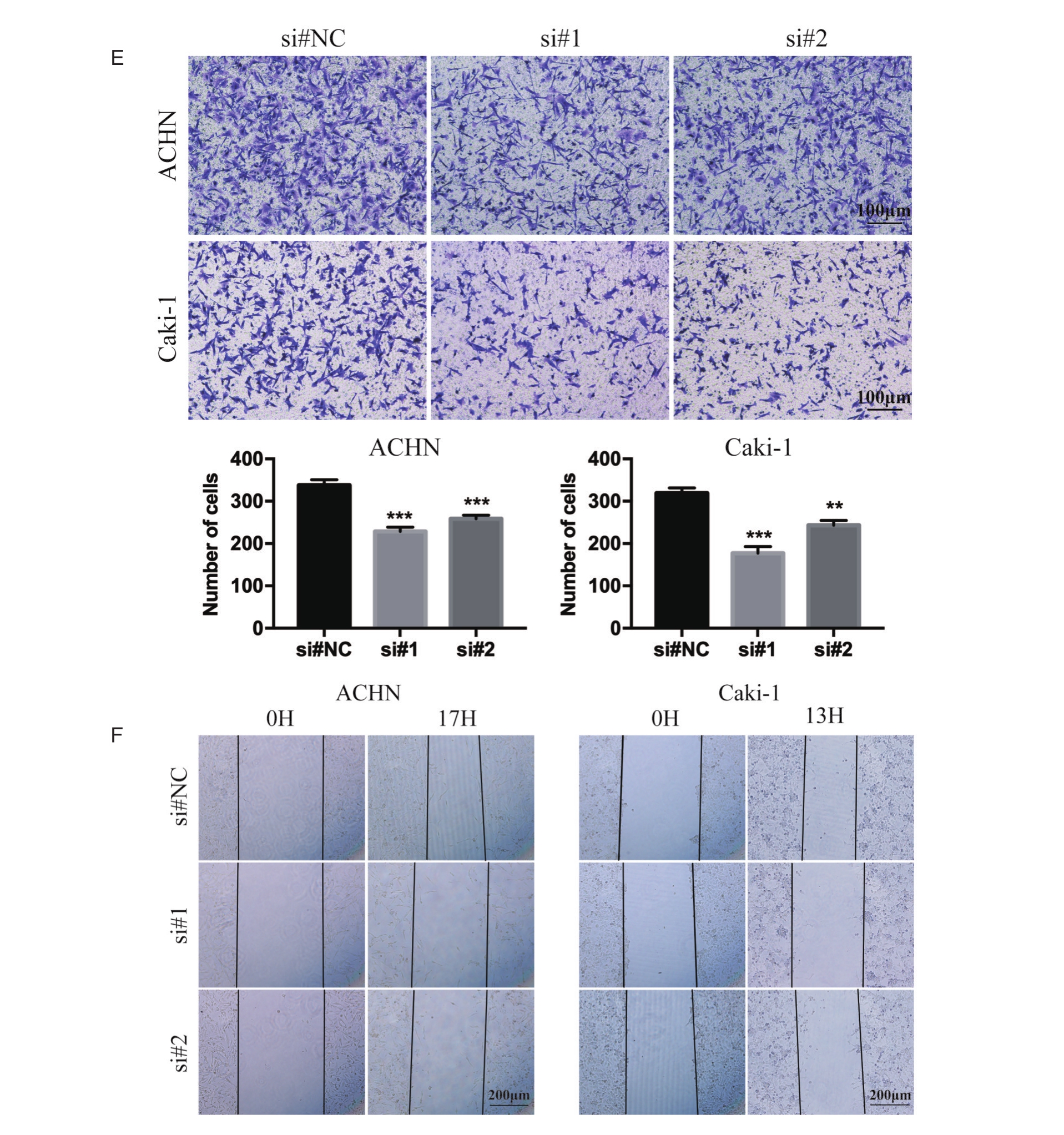
图3 沉默 circDOCK4抑制ccRCC细胞的增殖、迁移和侵袭
A.向ACHN、Caki-1转染siRNAs后qRT-PCR检测circDOCK4和circDOCK4 mRNA;B.EdU实验检测细胞转染siRNAs后的增殖能力,柱状图纵坐标为EdU+细胞与Hoechst+细胞的比值;C.克隆形成实验检测细胞转染siRNAs后的增殖能力;D.MTS实验检测细胞转染siRNAs后的增殖能力;E.Transwell小室实验检测细胞转染siRNAs后的侵袭能力;F.划痕愈合实验检测细胞转染siRNAs后的迁移能力。(*P<0.05,**P<0.01,***P<0.001)

图4 circDOCK4核浆分离实验circDOCK4主要定位于细胞浆,18S RNA作为细胞浆定位的内参基因,U6作为细胞核定位的内参基因
在本研究中我们发现circDOCK4在ccRCC组织中异常高表达,同时在我们收集的20对ccRCC组织以及细胞系ACHN、Caki-1中得到了验证。在核酸电泳和RNaseR消化实验证实circDOCK4的成环性的基础上,为了进一步明确circDOCK4在ccRCC中的生物学功能,我们通过在体外水平敲降ACHN和Caki-1中circDOCK4的水平,利用EdU、MTS和克隆形成实验检测细胞的增殖能力,结果发现沉默circDOCK4能显著抑制ACHN的Caki-1的增殖;利用Transwell小室实验和划痕愈合实验发现沉默circDOCK4能明显降低ACHN的Caki-1的迁移和侵袭能力。核浆分离实验则表明circDOCK4主要定位于细胞浆,由于circRNA含有许多miRNA的应答原件[22],能够作为ceRNA从而调控肿瘤的进展,此外,CircInteractome[23]和 starBase[24]软件预测circDOCK4可能具有与13个miRNA结合的能力,提示circDOCK4很有可能在胞浆中通过作为海绵吸附miRNA而发挥转录后调控的作用,进而影响ccRCC细胞的增殖、迁移和侵袭,我们接下来将继续深入对circDOCK4下游分子机制的探索。
综上所述,本研究发现circDOCK4在ccRCC组织和细胞系中高表达,具有促进ccRCC细胞的增殖、迁移和侵袭的能力,有望成为ccRCC的生物标志物或治疗靶点。
[1] Siegel RL,Miller KD,Jemal A.Cancer statistics,2020[J].CA Cancer J Clin,2020,70(1):7-30.
[2] Capitanio U,Montorsi F.Renal cancer[J].Lancet,2016,387(10021):894-906.
[3] W.Marston Linehan.Genetic basis of kidney cancer:Role of genomics for the development of disease-based therapeutics[J].Genome Res,2012,22(11):2089-2100.
[4] Dabestani S,Thorstenson A,Lindblad P,et al.Renal cell carcinoma recurrences and metastases in primary non-metastatic patients:a population-based study[J].World J Urol,2016,34:1081-1086.
[5] Hsieh JJ,Purdue MP,Signoretti S,et al.Renal cell carcinoma[J].Nat Rev Dis Primers,2017,3:17009.
[6] Zhang Y,Liang W,Zhang P,et al.Circular RNAs:emerging cancer biomarkers and targets[J].J Exp Clin Cancer Res,2017,36:152.
[7] Memczak S,Jens M,Elefsinioti A,et al.Circular RNAs are a large class of animal RNAs with regulatory potency[J].Nature,2013,495(7441):333-338.
[8] Zhong YX,Du YJ,Yang X,et al.Circular RNAs function as ceRNAs to regulate and control human cancer progression[J].Mol cancer,2018,17(1):79.
[9] Du William W,Zhang C,Yang WN,et al.Identifying and Characterizing circRNA-Protein Interaction[J].Theranostics,2017,7(17):4183-4191.
[10] Legnini I,Di Timoteo G,Rossi F,et al.Circ-ZNF609 is a circular RNA that can be translated and functions in myogenesis[J].Mol Cell,2017,66:22-37.
[11] Li ZY,Huang C,Bao C,et al.Exon-intron circular RNAs regulate transcription in the nucleus[J].Nat Struct Mol Biol,2015,22:256-264.
[12] Sanger HL,Klotz G,Riesner D,et al.Viroids are single-stranded covalently closed circular RNA molecules existing as highly base-paired rod-like structures[J].Proc Natl Acad Sci USA,1976,73(1):3852-3856.
[13] Enuka Y,Lauriola M,Feldman ME,et al.Circular RNAs are long-lived and display only minimal early alterations in response to a growth factor[J].Nucleic Acids Res,2016,4(3):1370-1383.
[14] Salzman J,Gawad C,Wang PL,et al.Circular RNAs are the predominant transcript isoform from hundreds of human genes in diverse cell types[J].PLoS One,2012,7(2):e3073.
[15] Guo JU,Agarwal V,Guo H,et al.Expanded identification and characterization of mammalian circular RNAs[J].Genome Biol,2014,15(7):409.
[16] Hansen TB,Kjems J,DAMGAARD CK.Circular RNA and miR-7 in cancer[J].Cancer Res,2013,73(18):5609-5612.
[17] Cocquerelle C,Mascrez B,Hetuin D,et al.Mis-splicing yields circular RNA molecules[J].FASEB J,1993,7(1):155-160.
[18] Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-674.
[19] Zhang X,Wang S,Wang H,et al.Circular RNA circNRIP1 acts as a microRNA-149-5p sponge to promote gastric cancer progression via the AKT1/mTOR pathway[J].Mol Cancer,2019,18(1):20.
[20] Liu H,Bi J,Dong W,et al.Invasion-related circular RNA circFNDC3B inhibits bladder cancer progression through the miR-1178-3p/G3BP2/SRC/FAK axis[J].Mol Cancer,2018,17(1):161.
[21] Feng Y,Yang Y,Zhao X,et al.Circular RNA circ0005276 promotes the proliferation and migration of prostate cancer cells by interacting with FUS to transcriptionally activate XIAP[J].Cell Death Dis,2019,10(11):792.
[22] Hansen TB,Jensen TI,Clausen BH,et al.Natural RNA circles function as efficient microRNA sponges [J].Nature,2013,495(7441):384-388.
[23] Dudekula DB,Panda AC,Grammatikakis I,et al.A web tool for exploring circular RNAs and their interacting proteins and microRNAs[J].RNA Biology,2016,13(1):34-42.
[24] Li JH,Liu S,Zhou H,et al.starBase v2.0:decoding miRNA-ceRNA,miRNA-ncRNA and protein-RNA interaction networks from large-scale CLIP-Seq data[J].Nucleic Acids Res,2014,42:D92-D97.
circDOCK4 promotes the proliferation,migration and invasion of clear cell renal cell carcinoma
中图分类号: