

岭南现代临床外科 ›› 2020, Vol. 20 ›› Issue (01): 84-92.DOI: 10.3969/j.issn.1009-976X.2020.01.019
摘要:
颅脑创伤(traumatic Brain injury,TBI)后的局部免疫炎症反应被认为是继发性脑损伤病理过程中最为重要的影响因素之一[1]。免疫炎性细胞因子的效应具有双重性,在脑损伤发生后早期,主要表现为神经毒性作用,而在随后的过程中则可以诱导神经修复和组织重建。早期对炎症反应的抑制可以减轻脑水肿,减少神经元的死亡或胶质增生。孕酮目前被证实具有抗炎[2],抗水肿,抗氧化,抗凋亡,修复DNA,抑制兴奋性递质,促进神经髓鞘修复,促进脑组织分泌脑营养性生长因子等多种促进神经损伤修复与再生的功能[3-5]。部分临床实验还证实在TBI早期应用孕酮可获得更好的预后,但孕酮治疗TBI的分子生物学机制尚不清楚。越来越多的证据表明,免疫炎症反应是脑损伤后继发性神经损伤的关键一环。因此本实验拟建立小鼠创伤性脑损伤模型[6],利用mNSS评分[7]、干湿重法、Western blot、免疫组织化学染色法及流式细胞计数法检测孕酮对神经功能、脑水肿、炎性因子、炎性细胞表达及免疫细胞的影响,初步探索孕酮在脑创伤后的免疫炎症调节作用及神经保护作用。
雄性C57BL/6小鼠(华阜康生物科技股份有限公司,许可证号scxk(京)2014-0004,中国北京),体重20~22 g,自由进食饮水,室温(25.0±0.5)℃,分笼喂养,自然光照。
将360只小鼠随机分为假手术组,孕酮治疗组和对照组。每组按处理方式不同分为5个亚组,分别在处理后第1、3、5、7天行mNSS评分检测、干湿重测脑组织水含量、Western blot、免疫组织化学染色(immunohistochemical staining,IHC)及脾流式细胞计数,即每个亚组每个时间点6只(n=6)。
1.3.1 TBI模型的制备 小鼠麻醉后,将其头部固定于立体定向仪。选取中线右侧旁开1 mm,人字缝以上1 mm处,开颅,暴露脑皮质,使用控制性脑皮质撞击仪(Custom Design&Fabrication公司,美国)设置打击深度1.33 mm,打击速度4.5 m/s,进行打击,缝合头皮。假手术组仅不对脑皮质打击,其余处理与另外两组相同。孕酮治疗组打击后1小时腹腔内注射孕酮(16 mg/kg),随后每天同一时间注射相同剂量,直至实验结束。对照组在相同时间点腹腔注射等量生理盐水。
1.3.2 神经功能检测 分别在处理后第1、3、5、7天根据mNSS评分表,从运动、感觉、平衡和反射四方面对各组小鼠进行神经功能评测,总分为0~18分,分数越高,说明动物的神经损伤越严重。
1.3.3 脑组织含水量测定 在造模后第1、3、5、7天对各组小鼠进行断头处理,使用精密电子分析天平(METLLER TOLEDO公司,瑞士)测其湿重。然后置于100℃烤箱烘烤24 h,称干重。分别计算各组小鼠脑组织水含量,公式为:脑含水量(%)=(湿重-干重)/湿重×100%。
1.3.4 蛋白印迹法(Western Blot) 取各组处理后第1、3天小鼠损伤同侧脑组织,加入适量PMSF、裂解液,裂解30min;用BCA法测定其蛋白浓度,取等量蛋白于SDS-PAGE中电泳分离;电转移到硝酸纤维膜(PVDF膜)上,分别孵育以下一抗:兔抗人TNF-α(1∶10 000),兔抗小鼠 NF-κB(1∶500),小鼠抗人 IL-1β(1∶1000),大鼠抗人 IL-10(1∶1000)(abcam公司,英国),4℃过夜。孵育相应二抗(1∶5 000)(中杉金桥公司,北京),经曝光液处理,使用凝胶成像仪进行曝光。通过Image J软件对蛋白条带进行分析,比对灰度值,统计软件进行分析。
1.3.5 免疫组织化学染色 取脑组织切片,经酒精和二甲苯脱蜡处理,柠檬酸钠液对切片进行抗原修复,3%过氧化氢阻断内源性过氧化物酶,常温3%BSA封闭1 h后,分别加入相应一抗:兔抗人CD3,GFAP,Iba-1,MPO,4度过夜,加入相应二抗,室温孵育2 h。PBS洗涤后,在辣根过氧化物酶标记的三抗室温下孵育,PBS洗涤后,进行DAB显色,苏木复染,进行脱水处理,封片。光镜下观察照相。在各组小鼠相同皮质部位,随机选取5个视野,使用Image J软件进行细胞计数,用统计软件进行分析。
1.3.6 流式细胞术测定小鼠脾脏中Treg细胞比例取各组处理后第1、3天小鼠脾脏。研磨,加入红细胞裂解液(索莱宝科技有限公司,北京)。离心后弃去上清,设置单阳及空白对照,其余样品加入相应抗体:CD4+、CD25+、CD4+和CD25+双阳性、Foxp3,避光孵育,离心弃去上清,加入破膜液,4℃下避光孵育。离心弃去上清,除空白和单阳外,均加入Foxp3,4度下避光孵育,离心弃去上清,对细胞进行过滤处理后上机。
采用SPSS 22.0统计软件进行数据处理与分析。计量资料以均数±标准差(xˉ±s)表示,采用配对t检验。以P<0.05为差异具有统计学意义。
分别在处理后1、3、5、7天3组小鼠进行mNSS评分。处理后第1天,脑创伤组小鼠mNSS评分无显著性差异,均高于假手术组;孕酮治疗组小鼠mNSS评分在脑创伤后第3、5、7天时明显低于创伤对照组(P<0.05),二者均明显高于假手术组(P<0.05)(表1)。伤后第1天,孕酮治疗组和对照组小鼠mNSS评分无显著性差异,均明显高于假手术组(P<0.05);随后第3、5、7天,孕酮治疗组小鼠mNSS评分明显低于对照组,但仍高于假手术组(P<0.05)。
表1 三组小鼠不同时间点mNSS评分

时间第1天第3天第5天第7天假手术组(n=6)4.2±1.30 4.0±1.58 5.8±1.30 4.4±2.07创伤对照组(n=6)14.0±1.00 13.0±1.58 12.6±1.14 12.0±1.58孕酮治疗组(n=6)14.0±1.22 9.8±0.83 10.0±1.58 8.2±1.30 P值0.023 0.021 0.003 0.016
同创伤对照组相比,孕酮治疗组小鼠的脑组织水含量在伤后第 1、3、5、7天明显减轻(P<0.05);二者脑组织水含量均较假手术组明显增高(P<0.05)。如表2所示,孕酮治疗组小鼠脑组织含水量在伤后第1、3、5、7天明显减轻,与假手术组比较无显著性差异;而同创伤对照组相比,差异有统计学意义(P<0.05)。
表2 三组小鼠不同时间点脑组织水含量(%)
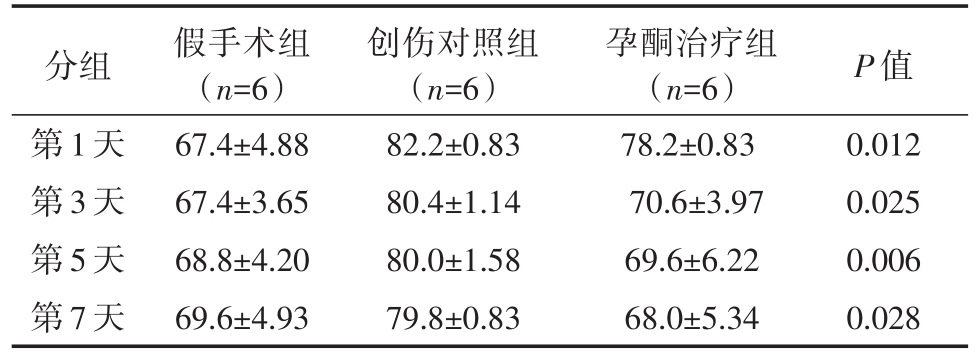
分组第1天第3天第5天第7天假手术组(n=6)67.4±4.88 67.4±3.65 68.8±4.20 69.6±4.93创伤对照组(n=6)82.2±0.83 80.4±1.14 80.0±1.58 79.8±0.83孕酮治疗组(n=6)78.2±0.83 70.6±3.97 69.6±6.22 68.0±5.34 P值0.012 0.025 0.006 0.028
与假手术组相比,伤后第1、3天,创伤组炎性因子(IL-1β、TNF-α、NF-κB、IL-10)表达和炎性细胞(CD3、GFAP、Iba-1、MPO)数量显著增加(P<0.05);与创伤对照组相比,孕酮治疗组炎性因子表达和炎性细胞数量明显下降(P<0.05),见图1。
处理后第1、3天,同假手术组相比,脑创伤组小鼠脑损伤灶中GFAP(星形胶质细胞)及Iba-1(小胶质细胞)阳性胶质细胞数量明显增加(P<0.05);同创伤对照组相比,孕酮能明显减少脑损伤灶处GFAP及 Iba-1细胞数量(P<0.05)。MPO(中性粒细胞)及CD3(T细胞)细胞在处理后第1天表现出明显差异,创伤组较假手术组细胞数明显增多(P<0.05),同创伤对照组相比,孕酮能明显减少脑损伤灶处MPO及CD3细胞数量(P<0.05);处理后第3天统计结果显示,MPO及CD3细胞数量在孕酮治疗组及假手术组无明显差异,二者较创伤对照组细胞数量减少(P<0.05),见图2。
应用流式细胞术检测小鼠脾脏中Treg细胞比例。TBI后,小鼠脾脏中Treg有下降趋势。同创伤对照组相比,孕酮治疗组显著减轻脾脏内Treg减少水平,但仍未达到假手术组水平,各组小鼠脾脏内Treg数量差异有统计学意义(P<0.05),见图3。
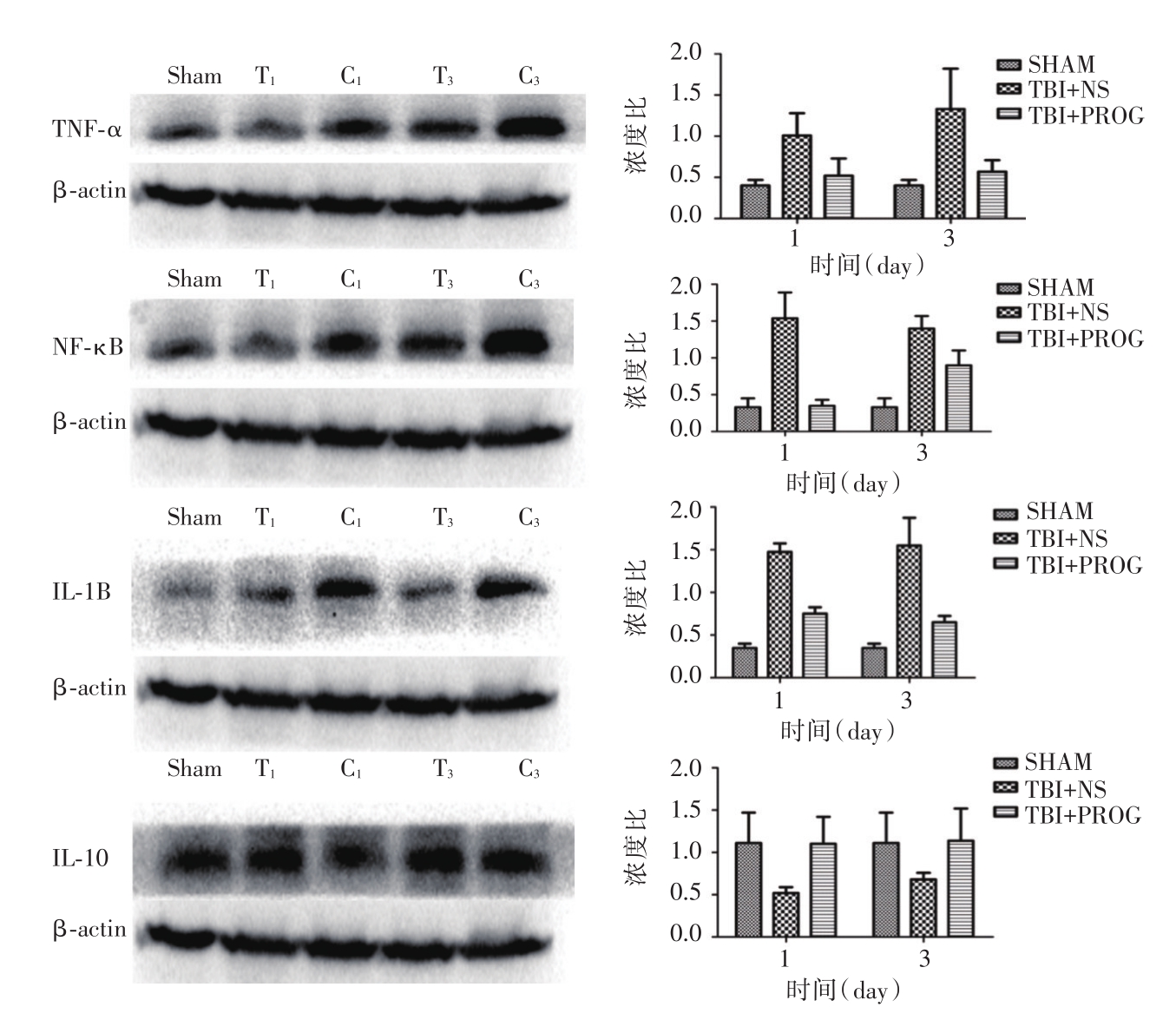
图1 不同时间点三组小鼠Western blot结果比较
Western blot检测伤后第1、3天小鼠TNF-α、NF-κB、IL-1β 及 IL-10 的表达。Sham代表假手术组,T1、T3代表伤后第1、3天孕酮治疗组,C1、C3代表伤后第1、3天创伤对照组。与假手术组相比,伤后第1、3天,创伤组炎性因子(IL-1β、TNF-α、NF-κB、IL-10)表达数量显著增加(P<0.05);与创伤对照组相比,孕酮治疗组炎性因子表达明显下降(P<0.05)
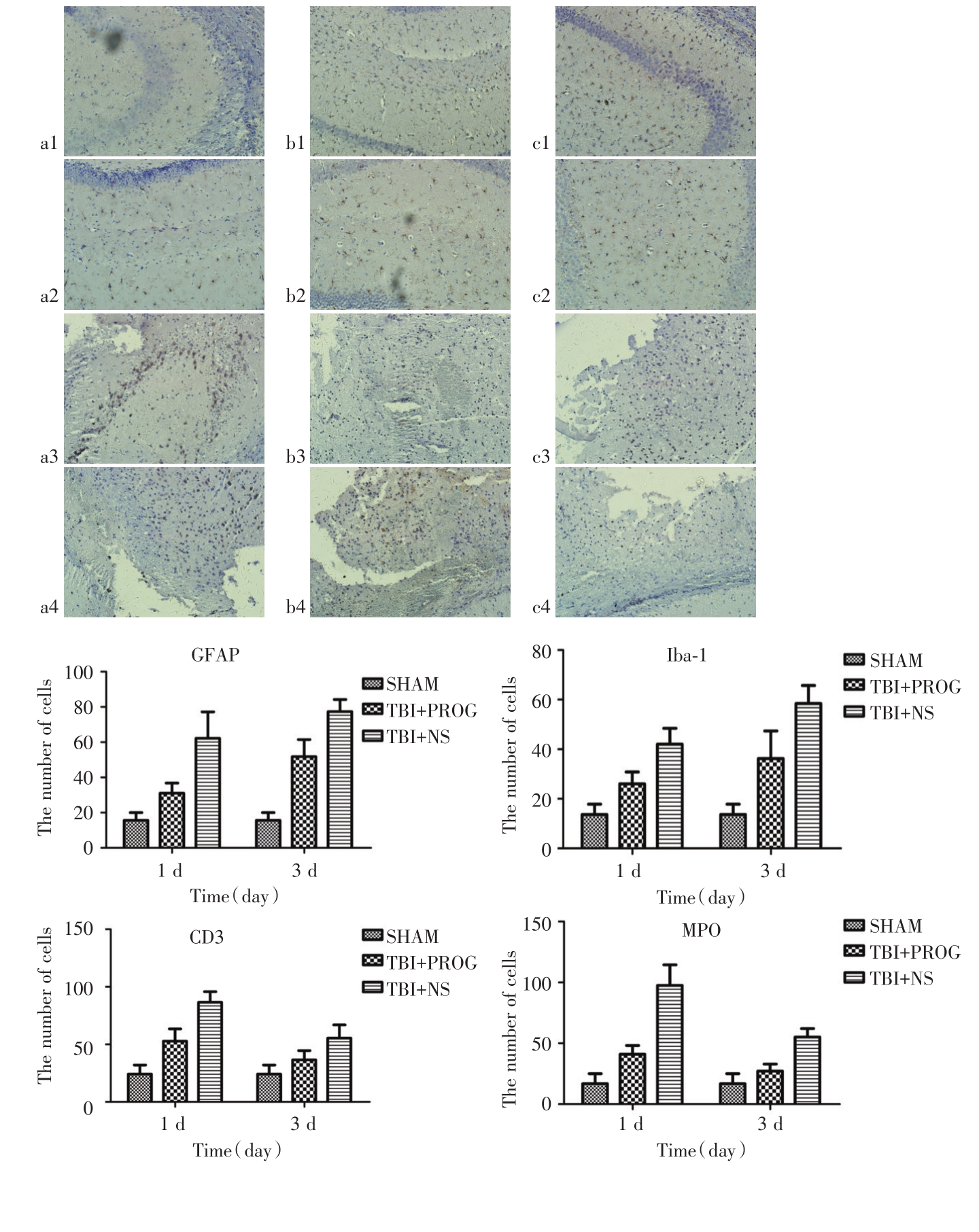
图2 免疫组化染色显示结果及各组目标细胞阳性数目统计
A:a.假手术组的 GFAP、Iba-1、CD3、MPO免疫组化染色结果;b.伤后第1天孕酮治疗组 GFAP、Iba-1、CD3、MPO免疫组化染色结果;c.伤后第1天创伤对照组 GFAP、Iba-1、CD3、MPO免疫组化染色结果。B:伤后第1、3天孕酮治疗组GFAP及Iba-1表达量较SHAM组减少(P<0.05),较创伤对照组多(P<0.05);伤后第1天孕酮治疗组CD3及MPO表达量较SHAM组增多(P<0.05),较对照组少(P<0.05),第3天较SHAM组无差异(P>0.05)。

图3 不同时间点三组小鼠脾脏Treg细胞数量统计结果
在处理后第1、3天,孕酮治疗组小鼠脾脏内Treg细胞所占比例SHAM组减少(P<0.05),较对照组多(P<0.05)
目前越来越多证据表明,免疫炎症反应是脑损伤后继发性神经损伤的关键一环[8,9]。已经明确,脑损伤后,脑组织内的炎症反应的迅速激活,多种细胞因子(IL-1β、TNF-α、IL-12等)数量的上调等,这些免疫系统的变化,促进了神经元的凋亡,坏死,破坏血脑屏障,加重了神经功能的损伤[10]。本次实验以创伤性脑损伤模型小鼠为实验对象,证实孕酮可以调节小鼠创伤性脑损伤后免疫炎症反应及改善其预后,并初步发现其作用机制同Treg的关联性。
本次实验显示,小鼠TBI后引起脑组织炎症反应,脑损伤灶处大量炎性细胞聚集,同假手术组相比,创伤组炎性因子含量及炎性细胞数量增多,差异有统计学意义(P<0.055);但同创伤对照组相比,孕酮治疗组小鼠脑损伤灶炎症反应明显减轻。而对炎症细胞的抑制可以减轻脑水肿和脑损伤[11]。本实验也证实孕酮治疗后,脑创伤后小鼠脑组织水肿减轻,其神经功能改善,差异有统计学意义(P<0.05)。近年新发现的免疫调节T细胞是一种具有免疫调节能力的T淋巴细胞,它能够调控多系统炎症反应,缓解组织损伤。随着分子生物学技术的深入发展和广泛应用,越来越证实Treg具有良好的免疫调节功能,如在脑缺血的研究中已经部分证实Treg具有免疫调节能力和调控炎症反应的功能,促进缺血性脑损伤时神经功能的恢复[12,13]。本实验从调节性T细胞入手,发现孕酮在创伤性脑损伤后发挥作用机制同T细胞的相关关系。颅脑创伤后,注射孕酮使脑组织内调节性T细胞数量明显增多,而炎性细胞及炎性因子的数量明显减低,由此可以推测出,孕酮可能通过上调Treg数量来间接减少炎性因子及炎性细胞的数量,减少脑创伤后炎症反应,减轻脑水肿,改善预后。
核转录因子(NF-κB)在颅脑损伤后活性明显升高,是炎症反应进程中的上游调控因子,可促进多种炎症细胞因子的基因转录,如IL-1β,TNF-α,C3和GFAP等,在炎症细胞因子介导的炎症反应中起重要作用,且NF-kB是调节Treg的关键信号,是产生活性 Treg的必须因子[14,15]。多种细胞因子如肿瘤坏死因子(tumor necrosis factor-a)TNF等都受到孕酮与Treg的调控。Treg可分泌和表达IL-10等抑炎性细胞因子,进而作用于效应性T细胞,缓解炎症反应。本次实验运用脾流式细胞计数,比较了各组脑损伤后脾脏内Treg的数量变化,结果显示孕酮显著增加了脑损伤后脾脏内Treg数量,同损伤对照组相比,差异有统计学意义。可初步断定孕酮在脑损伤后的抗炎症作用同Treg之间存在调节关系,即孕酮可能通过调控了Treg的水平来实现的。即使二者之间没有直接调节关系,由于Treg具有抑制炎性反应的功能,在孕酮治疗TBI同时人工促进Treg在脑损伤区的归巢,有望增强孕酮治疗TBI的疗效。通过本次实验们了解到,孕酮和调节性T细胞及炎性反应存在某种间接的联系,下一步我们将着重研究证实孕酮与T细胞及炎性因子的调控机制。
本次实验通过创建创伤模型,设立对照及空白对照组,比较了孕酮治疗小鼠预后评分,脑组织内炎性细胞及因子表达情况,间接推测出运动对于颅脑创伤具有保护作用,可能是通过调控Treg细胞实现的。但本次实验仍有一定不足,例如样本数量仍较小,对于mNSS评分、脑组织含水量以及细胞计数存在一定主观性等。综上,可以证实孕酮调节了创伤后局部的免疫炎症反应,改善了脑创伤后神经功能的预后。但孕酮在创伤性脑损伤后的具体作用机制尚不明确,需要进一步研究证实。
[1] Helmy A,De Simoni MG,Guilfoyle MR,et al.Cytokines and innate inflammation in the pathogenesis of human traumatic brain injury[J].Prog Neurobiol,2011,95(3):352-372.
[2] 潘德生,刘伟国,杨小锋,等.黄体酮对创伤性脑损伤后炎症因子的抑制作用的研究[J].中风与神经疾病杂志,2013,309(4):295-297.
[3] Pascual JL,Murcy MA,Li S,et al.Neuroprotective effects of progesterone in traumatic brain injury:blunted in vivo neutro-phil activation at the blood-brain barrier[J].Am J Surg,2013,206(6):840-845.
[4] Webster KM,Wright DK,Sun M,et al.Progesterone treatment reduces neuroinflammation,oxidative stress and brain damage and improves long-term outcomes in a rat model of repeated mild traumatic brain injury[J].J Neuroinflammation,2015,12:238.
[5] Deutsch ER,Espinoza TR,Atif F,et al.Progesterone's role in neuroprotection:a review of the evidence [J].Brain Res,2013,15(30):82-105.
[6] 吴增宝,钟春龙,高阳,刘巧玲,等.小鼠控制性脑皮质撞击模型的构建及分级[J].中华神经外科杂志,2013,12(5):431-434.
[7] Li Z1,Wang B,Kan Z,et al.Progesterone increases circulat-ing endothelial progenitor cells and induces neural regeneration after traumatic brain injury in aged rats[J].J Neurotrauma,2012,29(2):343-353.
[8] Schwarzmaier SM,Plesnila N.Contributions of the immune sys-tem to the pathophysiology of traumatic brain injury-evidence by intravital microscopy[J].Front Cell Neurosci,2014,4,8:358.
[9] Peruzzotti-Jametti L,Donega M,Giusto T,et al.The role of the immune system in central nervous system plasticity after acute injury[J].Neuroscience,2014,283:210-221.
[10] Faden AI.Microglial activation and traumatic brain injury[J].Ann Neurol,2011,70:345-346.
[11] 杨汀,樊光辉,刁波.高危后循环短暂性脑缺血发作患者CD4+CD25+调节性T细胞检测及意义[J].中华动脉硬化杂志,2013,21(8):755-757.
[12] Kenne E1,Erlandsson A,Lindbom L.Neutrophil depletion re-duces edema formation and tissue loss following traumatic brain injury in mice[J].J Neuroinflammation,2012,9:17.
[13] Ito M,Komai K,Mise-Omata S,et al.Brain regulatory T cells suppress astrogliosis and potentiate neurological recovery[J].Nature,2019,565(7738):246-250.
[14] Ruan Q,Chen YH.Nuclear factor-κB in immunity and inflam-mation:the Treg and Th17 connection[J].Adv Exp Med Biol,2012,946:207-221
[15] Gückel E,Frey S,Zaiss MM,et al.Cell-intrinsic NF-κB activa-tion is critical for the development of natural regulatory T cells in mice[J].PLoS One,2011,6(5):e20003.
Studies on the role of progesterone in the regulation of immune inflammation and the improvement of prognosis in traumatic brain injury
中图分类号: