

岭南现代临床外科 ›› 2020, Vol. 20 ›› Issue (02): 133-138.DOI: 10.3969/j.issn.1009-976X.2020.02.001
• 论著与临床研究 • 下一篇
摘要:
·论著与临床研究·
脑胶质瘤是原发于中枢神经系统的一种恶性肿瘤,发病超过颅脑肿瘤的一半[1]。目前针对脑胶质瘤的治疗方法以手术治疗为主,并辅以放疗和化疗。然而手术并不能将肿瘤完全切除,放化疗对预后的改善也不明显,肿瘤复发率高。因此,脑胶质瘤的治疗手段,还需从更多角度进行探究,如靶向治疗和免疫治疗等。
DCs是一种很重要的抗原提呈细胞,在纤维肉瘤[2]、黑色素瘤[3]等多种肿瘤中能识别肿瘤抗原,并引发T淋巴细胞等多种免疫细胞产生抗肿瘤的免疫反应。然而,在乳腺癌[4]、肺癌[5,6]、胰腺癌[7]等许多肿瘤中,肿瘤细胞反过来也能影响树突状细胞的免疫表型或功能,以规避来自免疫系统的攻击,使机体表现出肿瘤免疫抑制的状态。同时,有文献报道,在肝癌[8]、乳腺癌[9]等肿瘤中,对肿瘤微环境中的树突状细胞进行干预,可一定程度地刺激抗肿瘤效应,抑制肿瘤生长。
凝血酶敏感蛋白1(Thrombospondin 1,TSP-1)是凝血酶敏感蛋白类中的一种,在DCs中表达和分泌的TSP-1的主要作用是抑制DCs的成熟以及影响其分泌细胞因子的功能[10,11]。TSP-1 产生免疫抑制的功能在调节免疫平衡方面不可或缺,但也可能使肿瘤细胞处于更有利的生长环境。
因此,研究脑胶质瘤对树突状细胞TSP-1表达水平和表型及功能的影响,对揭示胶质瘤肿瘤微环境中肿瘤细胞与免疫细胞相互作用的机制必不可少,同时也为脑胶质瘤的免疫治疗提供一定的理论依据。
DMEM培养基、1640培养基、胎牛血清(fetal bovine serum,FBS)和胰蛋白酶和、optiMEM培养基购自美国Gibco公司。ELISA试剂盒购自深圳市达科为生物技术股份有限公司。双抗(青霉素+链霉素)购自Sigma-Aldrich公司。Lipofectamine 3000、P 3000转染试剂购自Invitrogen公司。抗TSP1抗体、HRP-山羊抗兔IgG抗体均购自赛信通(上海)生物试剂有限公司。
1.2.1 原代细胞培养 将胶质母细胞瘤组织切碎,用无菌的胰蛋白酶消化并分离得到胶质母细胞瘤原代细胞(以下简称“肿瘤细胞”)。肿瘤细胞培养于含10%(体积比)FBS的DMEM培养基中,于37℃、5%CO2浓度的细胞培养箱中进行培养。细胞隔1~2天更换培养基,每3天传代培养1次。
1.2.2 单核细胞的分离和诱导 用Ficoll人外周血淋巴细胞分离液以密度梯度离心法从外周血中分离出单核细胞,用靶向CD14分子的免疫磁珠纯化单核细胞,使其纯度达95%以上。经过纯化的单核细胞培养于含10%FBS、25 ng/mL GM-CSF和10 ng/mL IL-4的RMPI 1640培养基中。细胞隔2天换液,培养至第6天,单核细胞已被诱导至未成熟树突状细胞(immature dendritic cells,iDCs)阶段,去除培养基,mDC组加入含10%FBS的RMPI 1640培养基,DC+TCM组加入等量含10%FBS和20%(体积比)TCM的RMPI 1640培养基,继续培养24 h。第7天均更换为含10%FBS和10 μg/mL LPS的RMPI 1640培养基继续培养48 h,将iDCs诱导为成熟树突状细胞(mature dendritic cells,mDCs)。
1.2.3 TSP-1小干扰RNA转染 DC+TCM+Si-TSP-1组DCs在加入TCM培养24 h后,取其种于24孔板,贴壁生长12~18 h,细胞密度达80%。按照艾基siRNA转染说明书进行转染。在15 mL离心管中加入200 μL optiMEM培养基,根据转染孔数加入3 μL/孔的Lipofectamine 2000试剂,混匀静置5 min;在另一个15 mL离心管中加入200 μL optiMEM培养基,加入3 μL/孔的siRNA,5 min后将Lipofectamine 2000悬液与siRNA悬液混合,静置30 min。最后将混合液加入600 μL含10%FBS的RMPI 1640培养基中,混匀后加入24孔板,在细胞培养箱中继续培养DCs,8 h后更换为含10%FBS和10 μg/mL LPS的RMPI 1640培养基继续诱导培养48 h。
1.2.4 TSP-1过表达质粒转染 mDC+TSP-1组DCs在加入TCM培养24 h后,取其种于24孔板,贴壁生长12~18 h,细胞密度达80%。按照艾基过表达质粒转染说明书进行转染。在15 mL离心管中加入200 μL optiMEM培养基,根据转染孔数加入3 μL/孔的Lipofectamine 2000试剂,混匀静置5 min;在另一个15 mL离心管中加入200 μL optiMEM培养基,加入 3 μL/孔的 TSP-1 质粒和 6 μL/孔的P3000试剂,5 min后将Lipofectamine 2000悬液与TSP-1质粒悬液混合,静置30 min。最后将混合液加入600 μL含10%FBS的RMPI 1640培养基中,混匀后加入24孔板,在细胞培养箱中继续培养DCs,8 h后更换为含10%FBS和10 μg/mL LPS的RMPI 1640培养基继续诱导培养48 h。
1.2.5 Western blot检测 用移液器吹打悬浮的mDCs并收集,裂解获取总蛋白,BCA法测定蛋白浓度。每组各取10 μg蛋白加入4×Loading buffer于98℃干浴锅变性5 min。配制SDS聚丙烯酰胺分离胶和浓缩胶,将样品和marker加入各孔道,90 V恒压下电泳20 min后,将电压调至120 V,电泳1 h;然后以250 mA恒流电转2 h将凝胶上的蛋白转移至PVDF膜上。之后将PVDF膜用5%(质量分数)牛奶封闭2 h,将对应分子量大小的条带置于 TSP-1(1∶1000)GAPDH(1∶5 000)一抗抗体中,4℃孵育过夜。TBST洗膜3次,每次10 min。将条带以与一抗来源对应的二抗于室温孵育2 h,TBST洗膜3次,每次10 min。最后加入化学发光剂显色,用拍照和分析结果。
1.2.6 流式细胞术 用PBS洗涤收集到的mDCs并重悬为单细胞悬液,每组均分为3管(1个对照管和2个检测管),向每管加入细胞活性染料,向2个检测管加入不同的荧光抗体(抗人HLA-DR、CD80、CD83和CD86),室温避光孵育30分钟,PBS洗涤后以200 μL PBS重悬细胞,流式细胞仪上机检测。
1.2.7 ELISA(酶联免疫吸附剂测定) 收集各组DCs培养上清,以10 000 rpm离心5 min,留取上清。按照说明书的方法,配制不同细胞因子(IL-10、IL-12p70和TNF-α)的标准品并绘制标准曲线,依照实验分组对样品进行测量,并代入标准曲线求出对应浓度。
1.2.8 统计学分析 所有实验均至少重复进行3次。使用GraphPad Prism 8.0.2对数据进行统计分析和制图。所有数据采用均数±标准差的方式表示。利用Shapiro-Wilk检验分析数据是否符合正态分布。两组之间统计分析采用t检验。当P<0.05时,认为差异有统计学意义。
在诱导培养树突状细胞的过程中,加入胶质瘤细胞培养上清TCM。流式细胞分析结果(图1A、1B)显示,加入TCM使树突状细胞的成熟度标志HLA-DR和CD83下调,而CD80和CD86则变化不明显。上述结果表明,胶质瘤细胞可抑制树突状细胞的成熟。
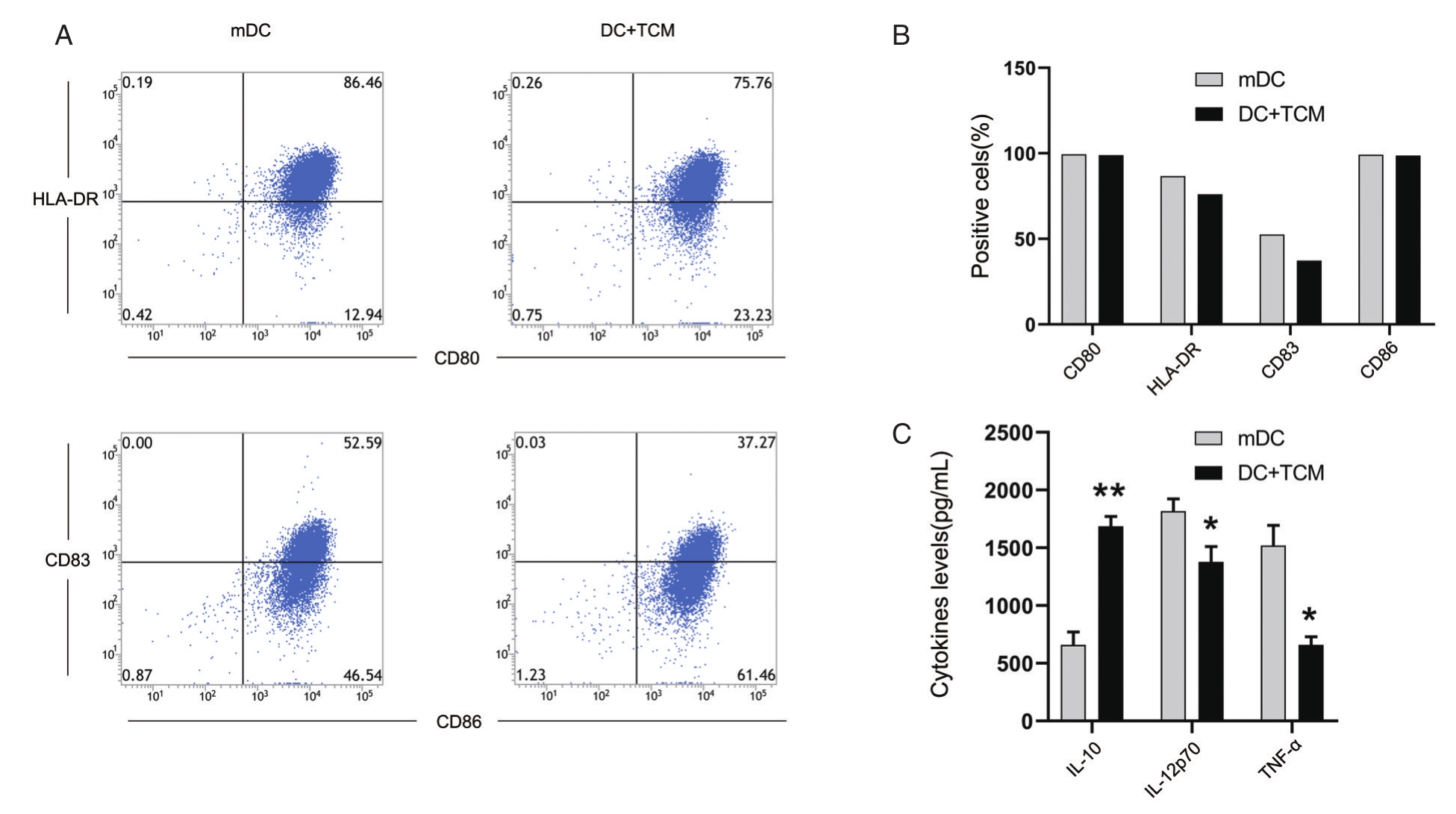
图1 加入TCM对DCs成熟度及分泌细胞因子功能的影响 A、B.流式细胞术检测加入TCM后DCs成熟度标志物的阳性细胞比例;C.ELISA检测加入TCM后DCs分泌细胞因子的水平。*表示P<0.05,**表示P<0.01
通过ELISA法对不同培养条件树突状细胞的培养上清中几种不同细胞因子的水平进行检测。结果(图1C)发现,加入TCM使树突状细胞Th2型细胞因子IL-10分泌增加(P<0.01),而Th1型细胞因子 IL-12p70(P<0.05)和 TNF-α(P<0.05)分泌减少。上述结果说明,TCM使树突状细胞的功能向抑制免疫的方向分化。

图2 RNA测序数据及加入TCM与DCs中TSP-1的关系 A.983对差异基因的KEGG通路分类分析;B.983对差异基因的样本差异散点图;C.差异基因表达量聚类热图;D.差异基因TSP-1在不同样本中的表达量;E.Western Blot检测加入TCM后DCs中TSP-1的表达水平
基于前述结果,针对树突状细胞培养条件的不同,我们对两种不同处理的树突状细胞(mDC组和DC+TCM组)进行了全RNA测序(共1对样品),以揭露TCM是通过影响树突状细胞的哪种基因的水平从而抑制其成熟的。通过KEGG通路分类和表达量聚类分析(图2A-D),我们筛选出TSP-1这一差异表达基因进行探究。Western blot结果(图2E)显示,加入TCM后,树突状细胞TSP-1的表达水平明显升高。以上结果证明,TSP-1可能参与了TCM抑制树突状细胞成熟的过程。
为了明确树突状细胞成熟度的改变与TSP-1水平的改变有无因果关系,我们进而对树突状细胞加以不同处理,下调TCM组树突状细胞TSP-1的表达,上调NC组树突状细胞TSP-1的表达,最后检测不同组别树突状细胞的成熟度以及TSP-1的表达水平。如Western blot结果(图3A)和流式细胞分析结果(图3B、3C)所示,胶质瘤细胞培养上清使树突状细胞TSP-1的表达水平上升,继而使其HLA-DR和CD83的水平下降,其成熟度降低;在加入胶质瘤细胞培养上清的同时,下调TSP-1的表达水平,树突状细胞HLA-DR和CD83的水平较TCM组有所回升,TSP-1水平的降低部分性地减弱了胶质瘤细胞培养上清抑制树突状细胞成熟的作用;同理,在正常诱导成熟的同时,上调TSP-1的表达水平,树突状细胞HLA-DR和CD83的水平较NC组有所降低,其成熟度降低。由以上结果可见,胶质瘤细胞培养上清通过诱导树突状细胞表达TSP-1增加从而抑制其成熟的。
同时,ELISA结果(图3D)显示,胶质瘤细胞培养上清使树突状细胞IL-10分泌水平升高(P<0.05),IL-12p70(P<0.0001)和TNF-α(P<0.05)分泌水平下降;在加入胶质瘤细胞培养上清的同时,下调TSP-1的表达水平,树突状细胞的IL-10分泌水平较TCM组有所降低(P<0.05),而IL-12p70(P<0.01)和TNF-α(P<0.05)的分泌水平有所上升,TSP-1水平的减少部分性地减弱了胶质瘤细胞培养上清使树突状细胞向抑制免疫方向分化的作用;同理,在正常诱导成熟的同时,上调TSP-1的表达水平,树突状细胞IL-10分泌水平较NC组上升(P<0.0001),而IL-12p70(P<0.01)和TNF-α(P<0.05)的分泌水平下降。由上述结果可看出,胶质瘤细胞培养上清通过诱导树突状细胞TSP-1表达升高,使其免疫抑制性介质分泌增多,而免疫促进性介质分泌减少,因而使树突状细胞的功能向抑制免疫的方向分化。

图3 TSP-1与DCs成熟度及分泌细胞因子功能的关系 A.Western Blot检测不同处理对DCs中TSP-1表达水平的影响;B、C.流式细胞术检测不同处理后DCs成熟度标志物的阳性细胞比例;D.ELISA检测不同处理后DCs分泌细胞因子的水平。*表示P<0.05,**表示P<0.01,****表示P<0.0001
DCs作为抗原提呈细胞,在人体的体液免疫和细胞免疫过程中发挥着至关重要的作用。死亡或濒死的肿瘤细胞的表面表达损伤相关分子模式(DAMPs),DCs通过模式识别受体PRRs(如Toll样受体 TLRs)检测 DAMPs[12],继而活化成熟。成熟的重要标志是共刺激分子HLA-DR、CD80、CD83和CD86的表达增多,以及促进T淋巴细胞增殖和分化的炎性细胞因子(如IL-12p70和TNF-α)分泌增多,信号得以传递至T淋巴细胞,从而激活一系列免疫反应。
但是在许多肿瘤中,DCs的活化成熟受到了抑制。M.MA等[4]发现,在乳腺癌和胰腺癌中,肿瘤源性的粒细胞刺激因子下调分化为经典树突状细胞1 cDC1的祖细胞中的IRF8表达水平,使cDC1的比例下降,从而削弱了cDC1对CD8+T淋巴细胞的激活作用,使肿瘤产生免疫耐受。H.KM等[13]通过体外和体内实验发现,黑色素瘤来源的TGFβ1和VEGF-A可抑制脾DCs的成熟和激活;同时,在黑色素瘤肺转移模型中,肺组织中DCs的成熟和激活也受到了抑制。因此,研究胶质瘤细胞与DCs的相互作用,有助于揭示胶质瘤疾病产生免疫耐受的机制,也对开发胶质瘤新疗法有着重要的指导意义。
有文献报道,TSP-1可抑制树突状细胞的活化成熟。D.V等[11]发现,TGF-β和PGE2等介质可上调iDCs及mDCs中TSP-1的分泌,在DCs通过TLRs结合识别相应配体的早期活化阶段,TSP-1的分泌增加使DCs中IL-12p70和TNF-α的合成减少;而在DCs与T淋巴细胞相互作用的晚期活化阶段,IL-12p70和TNF-α的分泌也受到了抑制。该研究揭示了TSP-1在DCs维持自身抗原耐受和终止炎症反应中都起着重要作用。我们的研究发现,TCM使DCs的TSP-1表达升高,使其分泌的IL-10增加,而IL-12p70和TNF-α减少,继而使DCs对T淋巴细胞的刺激作用受到抑制,这可能是胶质瘤产生免疫耐受的一种机制。
在S.RE等[14]对过敏性眼病的研究中,通过体内外实验发现TSP-1缺失的DCs可引起继发性T淋巴细胞反应及最终引发过敏性眼病的发生,而人为补充TSP-1对过敏性眼病有治疗作用。与之类似,在W.TY[15]等的研究中,针对肺癌和膀胱癌荷瘤小鼠进行DCs中TSP-1的敲除,肿瘤浸润的CD4(+)和CD8(+)T淋巴细胞明显增加,同时DCs分泌的IL-12和IFN-γ显著升高,这两种细胞因子都是刺激细胞毒性T淋巴细胞CTLs所需的。这些进一步佐证了TSP-1在抑制DCs成熟和发挥免疫功能中的关键作用。
我们的研究发现,TCM通过上调DCs的TSP-1水平,使其共刺激分子HLA-DR和CD83表达降低,这些共刺激分子是DCs刺激T淋巴细胞必不可少的信号分子;TCM使DCs分泌Th1型细胞因子减少,分泌Th2型细胞因子增多,使Th1/Th2平衡向Th2细胞占优势状态的方向漂移。因此,胶质瘤通过影响DCs中TSP-1的表达,最终可能影响T淋巴细胞对肿瘤细胞的杀伤作用,从而引起肿瘤免疫耐受。而这其中的具体机制仍有待我们的进一步探索。
综上,我们发现脑胶质瘤细胞通过上调树突状细胞TSP-1的水平,引起其成熟度降低,有助于阐明胶质瘤发生免疫耐受的相关机制,并为胶质瘤的免疫治疗提供新的探索角度。
[1] Ostrom QT,Gittleman H,Liao P,et al.CBTRUS Statistical Report:Primary brain and other central nervous system tumors diagnosed in the United States in 2010-2014[J].Neuro Oncol,2017,19(suppl_5):v1-v88.
[2] Ebrahimi-Nik H,Corwin WL,Shcheglova T,et al.CD11c MHCII GM-CSF-bone marrow-derived dendritic cells act as antigen donor cells and as antigen presenting cells in neoepitope-elicited tumor immunity against a mouse fibrosarcoma[J].Cancer Immunol Immunother,2018,67(9):1449-1459.
[3] Roberts EW,Broz ML,Binnewies M,et al.Critical Role for CD103(+)/CD141(+)Dendritic Cells Bearing CCR7 for Tumor Antigen Trafficking and Priming of T Cell Immunity in Melanoma[J].Cancer cell,2016,30(2):324-336.
[4] Meyer MA,Baer JM,Knolhoff BL,et al.Breast and pancreatic cancer interrupt IRF8-dependent dendritic cell development to overcome immune surveillance[J].Nat Commun,2018,9(1):1250.
[5] Schneider T,Hoffmann H,Dienemann H,et al.Non-small cell lung cancer induces an immunosuppressive phenotype of dendritic cells in tumor microenvironment by upregulating B7-H3[J].J Thorac Oncol,2011,6(7):1162-1168.
[6] Caronni N,Simoncello F,Stafetta F,et al.Downregulation of membrane trafficking proteins and lactate conditioning determine loss of dendritic cell function in lung cancer[J].Cancer Res,2018,78(7):1685-1699.
[7] Kenkel JA,Tseng WW,Davidson MG,et al.An Immunosuppressive Dendritic Cell Subset Accumulates at Secondary Sites and Promotes Metastasis in Pancreatic Cancer[J].Cancer Res,2017,77(15):4158-4170.
[8] Gonzalez-Carmona MA,Lukacs-Kornek V,Timmerman A,et al.CD40 ligand-expressing dendritic cells induce regression of hepatocellular carcinoma by activating innate and acquired immunity in vivo[J].Hepatology,2008,48(1):157-168.
[9] Huang Z,Gan J,Long Z,et al.Targeted delivery of let-7b to reprogramme tumor-associated macrophages and tumor infiltrating dendritic cells for tumor rejection[J].Biomaterials,2016,90:72-84.
[10] Demeure CE,Tanaka H,Mateo V,et al.CD47 engagement inhibits cytokine production and maturation of human dendritic cells[J].J Immunol,2000,164(4):2193-2199.
[11] Doyen V,Rubio M,Braun D,et al.Thrombospondin 1 is an autocrine negative regulator of human dendritic cell activation[J].J Exp Med,2003,198(8):1277-1283.
[12] Zelenay S,Reis e Sousa C.S.C.Adaptive immunity after cell death[J].Trends Immunol,2013,34(7):329-335.
[13] Hargadon KM,Bishop JD,Brandt JP,et al.Melanoma-derived factors alter the maturation and activation of differentiated tissueresident dendritic cells[J].Immunol Cell Biol,2016,94(1):24-38.
[14] Smith RE,Reyes NJ,Khandelwal P,et al.Secondary allergic T cell responses are regulated by dendritic cell-derived thrombospondin-1 in the setting of allergic eye disease[J].J Leukoc Biol,2016,100(2):371-380.
[15] Weng TY,Huang SS,Yen MC,et al.A novel cancer therapeutic using thrombospondin 1 in dendritic cells[J].Mol Ther,2014,22(2):292-302.
Glioma cells suppress the maturation of dendritic cells by upregulating the level of thrombospodin-1
中图分类号: