

岭南现代临床外科 ›› 2020, Vol. 20 ›› Issue (01): 48-54.DOI: 10.3969/j.issn.1009-976X.2020.01.011
摘要:
目前,主动脉瓣狭窄(AS)在中老年人群中的患病率逐年增加,65岁及以上的人口中约有26%存在主动脉瓣硬化,其中2%至7%的人群存在明显的AS[1]。组织学的证据提示主动脉瓣钙化导致的狭窄是心脏瓣膜病中AS最主要病因[2]。研究表明,AS疾病早期有着与动脉粥样硬化类似的致病过程,且有着共同的危险因素,如吸烟、高脂血症、高血压和糖尿病等[3]。不同的是,钙沉积、新生血管的形成和慢性炎症反应似乎是钙化瓣膜病变最后阶段的病理学特征。由于家族性高胆固醇血症的患者主动脉瓣钙化患病率和严重程度远高于非家族性高胆固醇血症患者[4],基于此,人们预防性地使用降脂类药物试图缓解AS的进展。然而,常规用于治疗冠脉粥样硬化的他汀类药物并不能有效的缓解AS的疾病进展[5-7]。截止目前,外科主动脉瓣置换术仍然是治疗该疾病最为有效的方法,但对于老年人、一般状况差以及合并多器官病变者,手术风险及术后死亡率仍较高。因此,迫切需要针对该疾病有效的治疗措施。
随着对疾病研究的逐渐深入,AS的致病过程已被视为涉及多种促炎因子参与的动态过程,包括:脂质和炎性细胞浸润;成纤维细胞的增殖[8]。其中,瓣膜间质细胞(VICs)的表型转变被认为是驱动AS发展的关键步骤。既往的研究证据显示,在钙化的主动脉瓣膜组织中,VICs的激活使得骨标志物如骨桥蛋白、骨黏连蛋白、Runx2/Cbfa1和APL的表达增加[9,10]。Jonathan等人的研究鉴定染色体16q22.1-q22.3与主动脉瓣钙化具有紧密联系,这提示遗传因素作用下的基因调控对AS的致病有重要的意义[11]。与此同时,FATIH等人的研究首次证明血管紧张素转换酶(ACE)插入/缺失基因型与主动脉瓣钙化的严重程度有关,这种影响可能归因于ACE的表达增加[12]。由此可见,遗传因素在AS的致病过程有一定的生物学意义,但目前研究尚存局限。因此,本研究中我们通过分析基因芯片数据,试图发现主动脉瓣钙化相关的潜在易感基因,为后续研究寻找潜在治疗靶点提供数据分析的支持。
GSE83453是基于平台GPL10558 Illumina Hu-manHT-12 V4.0生成的,并通过GEO数据库获取。GSE83453芯片包含27个主动脉瓣标本,包括10例双尖瓣主动脉瓣标本,9例主动脉瓣狭窄和8例对照组。基于数据的临床信息,我们将组织分型中存在钙化的样本纳入主动脉瓣钙化组,未存在钙化的样本纳入作为对照组。其中,二叶主动脉瓣和主动脉狭窄均纳入试验组(N=19),其余的属于对照组(N=8)。
Affy和 AffyPLM R 数据包(https://cran.r-proj-ect.org/)用于预处理下载的原始数据,经过背景校正,归一化和log2转换后得到基因探针表达矩阵。在该矩阵中,每一行代表探针,每一列代表样品。由于生成的表达矩阵以探针表达量的形式表示每个样品中基因的表达。差异基因分析是通过R自带的limma程序包计算的,并界定|logFC|>1,P<0.05。
基因的功能和途径富集分析有助于从功能学角度鉴定基因参与的生物学过程,基于DAVID在线基因功能注释数据库,将DEG与数据库中已有的生物学过程进行匹配。既往研究表明,瓣膜间质细胞参与的成骨表型的转化是主动脉瓣钙化最主要的发生机制;与此同时,病理学证据表明在主动脉瓣狭窄的病变处存在钙质的异常堆积,这提示钙离子代谢异常可能参与主动脉瓣钙化引起的狭窄[2]。因此,我们有目的性地筛选涉及成骨过程及钙离子代谢过程,以P<0.05认为有统计学意义。与此同时,我们对所有的差异基因进行KEGG通路富集分析,并筛选了可能参与的所有代谢通路,以P<0.05作为统计学意义。我们将生物学过程中显著富集的基因与通路分析中的全部基因进行比对,找到生物学过程富集基因参与的代谢通路。并认为这些基因可能是通过某一代谢通路参与该生物学过程。
STRING(https://string-db.org/)是一种在线生物学分析工具,可用于构建基因或蛋白质之间的关系网络。基于此,我们分别将全部差异基因以及生物学过程中显著富集的基因导入并构建基因分子间互作关系网络,以期从“宏观“和“微观“两种角度展示基因间的相互作用。结果导入至Cy-toscape(https://cytoscape.org/)实现基因间互作网络的可视化。
为了进一步诠释基因与心血管疾病的关联,通过CTD数据库预测已知基因与疾病之间的关联。我们将筛选的基因导入CTD数据库分析基因及产物与心血管疾病之间的关系。发现这些基因与多种心血管疾病高度相关,并报告了与这些基因有关的前五种心血管疾病。
基因芯片数据GSE83453中,钙化组样本19例,对照组样本8例。借助R中的limma程序包实现差异分析,总共鉴定出133个差异表达基因,包括82个下调基因和51个上调基因。

图1 差异分析结果
GO富集分析最终确认参与成骨细胞分化(富集倍数:9.49,P:9.18E-05),骨骼系统发育(富集倍数:7.20,P:4.12E-04)和骨化(富集倍数:8.81,P:0.002)三个生物学过程的共16个基因。
通路的富集分析结果表明,ECM-受体相互作用(富集倍数:14.16,P:4.23E-10),粘着斑(富集倍数:5.98,P:3.37E-06),PI3K-Akt信号通路(富集倍数:4.16,P:1.85E-05),蛋白质的消化吸收(富集倍数:9.33,P:1.86E-05),阿米巴病(富集倍数:7.74,P:6.24E-05),细胞因子-细胞因子受体相互作用(富集倍数:3.80,P:0.002),NF-κB信号通路(富集倍数:5.90,P:0.009),补体和凝血级联反应(富集倍数:5.95,P:0.02)和癌症的途径(富集倍数:2.35,P:0.03)代谢途径具有统计学意义。通过比对,得到基因SPP1和COL5A2。
基因SPP1参与成骨细胞分化(富集倍数:9.49,P:9.18E-05)和骨化(富集倍数:8.81,P:0.002)的生物学过程,参与的代谢通路有ECM-受体相互作用(富集倍数:14.16,P:4.23E-10),粘着斑(富集倍数:5.98,P:3.37E-06),PI3K-Akt信号通路(富集倍数:4.16,P:1.85E-05)。
COL5A2参与的生物学过程有骨骼系统发育(富集倍数:7.20,P:4.12E-04)和骨化(富集倍数:8.81,P:0.002),参与的代谢通路有ECM-受体相互作用(富集倍数:14.16,P:4.23E-10),粘着斑(富集倍数:5.98,P:3.37E-06),PI3K-Akt信号通路(富集倍数:4.16,P:1.85E-05),蛋白质的消化吸收(富集倍数:9.33,P:1.86E-05),阿米巴病(富集倍数:7.74,P:6.24E-05)。

图2 GO和KEGG富集分析结果
将主动脉瓣钙化组和对照组差异表达的基因批量导入STRING数据库构建差异基因间的互作网络。同时,我们将参与成骨细胞分化(富集倍数:9.49,P:9.18E-05),骨骼系统发育(富集倍数:7.20,P:4.12E-04)和骨化(富集倍数:8.81,P:0.002)三个生物学过程的共16个基因导入至STRING数据库中构建这些功能基因间的互作网络。结果导入至Cytoscape实现基因互作网络的可视化。其中,每个节点代表一个基因,边代表基因之间的相互作用。节点间的连线越多说明基因间功能上的依赖性越强。我们以自由度作为构建网络的标准,通过节点的大小及颜色反应互作关系,其中节点大小越大,颜色越趋近于蓝色提示自由度越高,在基因的互作中发挥的作用越大。反之,则基因互作越小。我们发现,基因SPP1和COL5A2与其他基因的关联较为密切。
SPP1参与的生物学过程和KEGG通路

类别GOTERM_BP_DIRECT GOTERM_BP_DIRECT KEGG_PATHWAY KEGG_PATHWAY KEGG_PATHWAY项目GO:0001649 GO:0001503 hsa04512 hsa04510 hsa04151名称成骨细胞分化骨化ECM-受体相互作用粘着斑PI3K-Akt信号通路基因数P 7 5 1 2 12 14 9.18E-05 0.002429537 4.23E-10 3.37E-06 1.85E-05富集倍数9.497737557 8.819327731 14.16160576 5.980872337 4.166385464
COL5A2参与的生物学过程和KEGG通路

类别GOTERM_BP_DIRECT GOTERM_BP_DIRECT KEGG_PATHWAY KEGG_PATHWAY KEGG_PATHWAY KEGG_PATHWAY KEGG_PATHWAY项目GO:0001501 GO:0001503 hsa04512 hsa04510 hsa04151 hsa04974 hsa05146名称骨骼系统开发骨化ECM-受体相互作用粘着斑PI3K-Akt信号通路蛋白质消化吸收阿米巴病基因数P 7 5 1 2 12 14 8 8 4.12E-04 0.002429537 4.23E-10 3.37E-06 1.85E-05 1.86E-05 6.24E-05富集倍数7.209961357 8.819327731 14.16160576 5.980872337 4.166385464 9.333785617 7.748803154
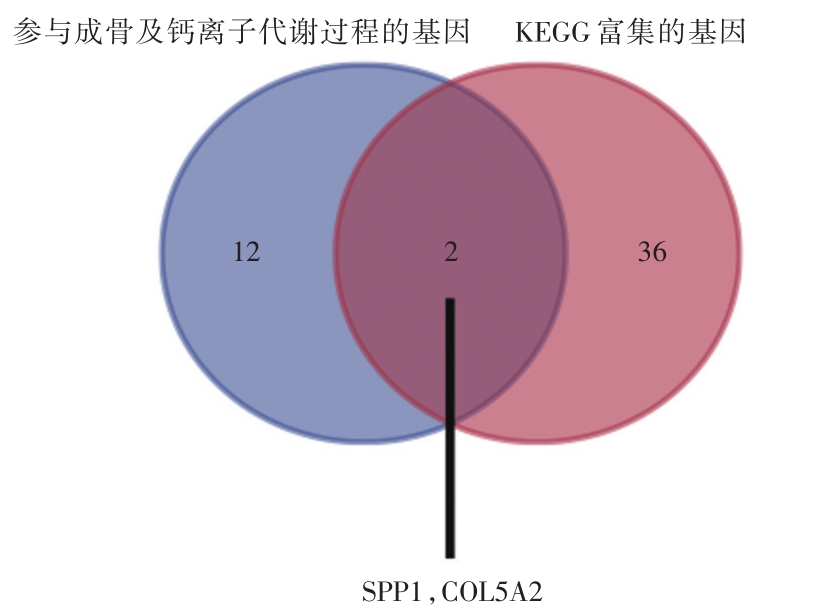
图3 SPP1和COL5A2是AVC潜在的易感基因

图4 差异表达基因间相互作用网络
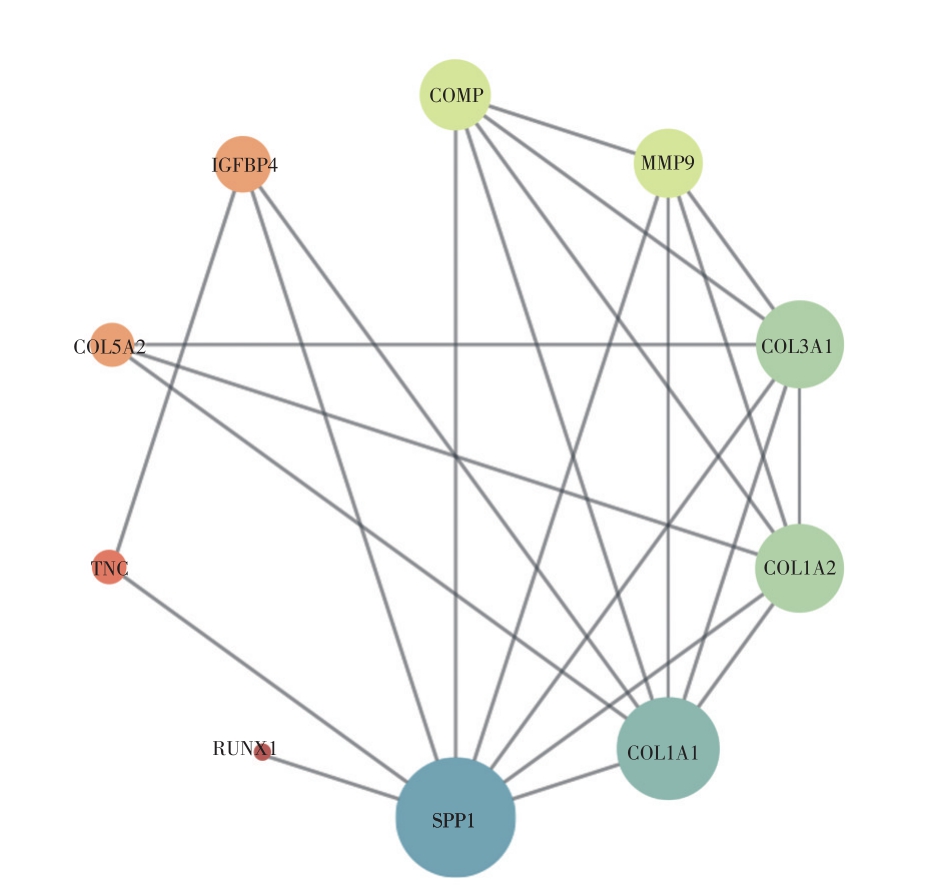
图5 成骨细胞分化,骨骼系统发育和骨化三个生物学过程富集基因间的相互作用网络
CTD数据库(http://ctdbase.org/)是一个用于预测基因-疾病关联的网站。通过将SPP1和COL5A2与数据库进行比对,发现了与SPP1、COL5A2高度相关的心血管疾病,并使用推断评分值显示这种关联。较高的分值表示较强的关联性。在这里,我们筛选了与关键基因产物相关的前五种疾病。

图6 预测SPP1和COL5A2相关联的心血管疾病
瓣膜性心脏病是全球范围内最为流行的心血管疾病之一,在欧美国家,风湿性心脏病导致的AS发病率逐渐下降,退行性心脏病的发病率却逐年上升,已成为导致主动脉瓣狭窄最主要的病因。在发展中国家,风湿性心脏病依然是引起AS发病率上升的主要病因[13]。由于早期患者个体差异大,缺乏特异性的临床表现,早期筛查及诊断阳性率低,一经诊断往往合并有严重的器质性病变。超声心动图作为重要的影像学手段,为瓣膜病变的严重程度以及疾病的预后提供了有意义的信息[14,15]。既往的研究显示,氧化修饰的低密度脂蛋白参与了主动脉瓣钙化的致病过程,围绕以抗脂作为早期干预的药物研究不断深入[16]。然而,多中心的队列研究表明,他汀类药物并不能有效的缓解AS的疾病进展[5-7],常规的主动脉瓣置换术(AVR)以及经导管主动脉瓣置换术(TAVI)仍是AS首选的治疗方式[17]。尽管及时有效的临床诊断和手术干预可使绝大多数中重度主动脉瓣狭窄患者得到救治,但是暴露于危险因素(如吸烟,高脂血症、高血压和糖尿病等)下的潜在易感人群随着病情的进展仍有较大的概率进展为有症状的瓣膜病变[3,18,19]。基于此,对 AS 致病机制的研究以及发现潜在的治疗靶点具有重要的意义。
尽管主动脉瓣钙化领域的临床研究层出不穷,但基于转录组学探讨主动脉瓣钙化的潜在易感基因的研究相对较少[20,21]。本研究借助生物信息学的方法,目的是挖掘与主动脉瓣钙化相关的潜在易感基因,为进一步研究主动脉瓣钙化的作用机制以及寻找潜在的治疗靶点提供参考。在数据集GSE83453中,我们以是否存在钙化作为分组的主要依据,将所有样本分为主动脉瓣钙化组和非钙化组,其中,钙化组样本19例,对照组样本8例。通过差异分析,共鉴定出133个差异表达基因,包括82个下调基因和51个上调基因。这说明在转录组层面上,这些基因在钙化的瓣膜组织和非钙化的瓣膜组织中存在表达上的差异。但是,单纯的差异分析只能说明基因表达量上的差异,并不诠释这些基因及其蛋白产物在功能上的作用。因此,我们进一步对这些差异表达的基因进行功能学上的分析,目的是为了从功能上去探索这些基因可能参与调控的生物学过程。借助DAVID功能注释分析数据库,我们将133个差异表达基因进行GO和KEGG富集分析,总共筛选出82个有统计学意义的功能注释和代谢通路。既往的研究表明,多种因素介导的异位骨化以及钙磷代谢异常是导致主动脉瓣硬化的生物学基础。随着疾病的不断进展,钙化的主动脉瓣叶逐渐硬化,最终演变成AS,产生呼吸困难、晕厥和心绞痛等临床症状[18,22]。基于此,我们有目的的对功能富集分析的结果进行筛选,选取成骨细胞分化(富集倍数:9.49,P:9.18E-05),骨骼系统发育(富集倍数:7.20,P:4.12E-04)和骨化(富集倍数:8.81,P:0.002)三个生物学过程的共16个基因作为感兴趣的基因。然后,我们将上述基因与代谢通路中富集的基因进行比对,目的是了解具有上述功能的基因是否在代谢通路中存在显著富集,得到基因SPP1和COL5A2。
分 泌 磷 蛋 白 1(secreted phosphoprotein 1,SPP1)又名骨桥蛋白(OPN),是成骨细胞特异性的标志物。Nalini M等人的研究发现,在钙化的主动脉瓣膜组织中,成骨细胞和骨标志物如骨桥蛋白、骨唾液蛋白、骨钙蛋白、碱性磷酸酶和成骨细胞特异性转录因子Cbfa1表达量明显增加,从而支持了主动脉瓣的钙化过程可能有成骨相关的调控过程[23]。既往研究表明,主动脉瓣钙化导致的狭窄取决于形成成骨表型的成骨细胞样细胞的存在,而在钙化的瓣膜中与成骨细胞功能密切相关的细胞外基质蛋白表达显著上调,这其中就包括骨桥蛋白[24]。本研究中,我们对SPP1进行功能注释及代谢通路分析,发现SPP1参与成骨细胞分化(富集倍数:9.49,P:9.18E-05)和骨化(富集倍数:8.81,P:0.002)的生物学过程,参与的代谢通路有ECM-受体相互作用(富集倍数:14.16,P:4.23E-10),粘着斑(富集倍数:5.98,P:3.37E-06),PI3K-Akt信号通路(富集倍数:4.16,P:1.85E-05)。其参与的生物学过程与既往的研究相一致。胶原蛋白Vα2链(collagen type V alpha 2 chain,COL5A2)是我们筛选得到的另一个潜在的易感基因,目前尚未发现足够的文献支持其在主动脉瓣钙化致病过程中的作用。基于对COL5A2的功能分析的结果显示,基因COL5A2主要参与的生物学过程有骨骼系统发育(富集倍数:7.20,P:4.12E-04)和骨化(富集倍数:8.81,P:0.002),参与的代谢通路有ECM-受体相互作用(富集倍数:14.16,P:4.23E-10),粘着斑(富集倍数:5.98,P:3.37E-06),PI3K-Akt信号通路(富集倍数:4.16,P:1.85E-05),蛋白质的消化吸收(富集倍数:9.33,P:1.86E-05),阿米巴病(富集倍数:7.74,P:6.24E-05)。通过功能注释的结果,我们发现COL5A2参与了成骨的代谢过程,这对于深入探讨COL5A2在瓣膜钙化的调控作用提供了数据分析上的支撑。
本项研究结果表明,SPP1和COL5A2可能是参与主动脉瓣钙化的潜在易感基因,为后续探讨主动脉瓣钙化具体作用机制提供了数据支持。
[1] Mazzone A,Epistolato MC,De Caterina R,et al.Neoangiogen-esis,T-lymphocyte infiltration,and heat shock protein-60 are biological hallmarks of an immunomediated inflammatory pro-cess in end-stage calcified aortic valve stenosis[J].J Am Coll Cardiol,2004,43(9):1670-1676.
[2] Bertazzo S,Gentleman E.Aortic valve calcification:a bone of contention[J].Eur Heart J,2017,38(16):1189-1193.
[3] Hoagland PM,Cook EF,Flatley M,et al.Case-control analysis of risk factors for presence of aortic stenosis in adults(age 50 years or older)[J].Am J Cardiol,1985,55(6):744-747.
[4] Ten Kate GR,Bos S,Dedic A,et al.Increased Aortic Valve Calcification in Familial Hypercholesterolemia Prevalence,Ex-tent,and Associated Risk Factors[J].J Am Coll Cardiol,2015,66(24):2687-2695.
[5] Cowell SJ,Newby DE,Prescott RJ,et al.A randomized trial of intensive lipid-lowering therapy in calcific aortic stenosis[J].N Engl J Med,2005,352(23):2389-2397.
[6] Chan KL,Teo K,Dumesnil JG,et al.Effect of Lipid lowering with rosuvastatin on progression of aortic stenosis-results of the aortic stenosis progression observation-measuring effects of ro-suvastatin(ASTRONOMER)trial[J].Circulation,2010,121(2):306-314.
[7] Rossebø AB,Pedersen TR,Boman K,et al.Intensive lipid low-ering with simvastatin and ezetimibe in aortic stenosis[J].N Engl J Med,2008,359(13):1343-1356.
[8] Rajamannan NM,Evans FJ,Aikawa E,et al.Calcific aortic valve disease:not simply a degenerative process:A review and agenda for research from the National Heart and Lung and Blood Institute Aortic Stenosis Working Group.Executive summary:Calcific aortic valve disease -2011 update[J].Circulation,2011,124(16):1783-1791.
[9] Rajamannan NM,Evans FJ,Aikawa E,et al.Calcific Aortic Valve Disease:Not Simply a Degenerative Process[J].Circula-tion,2011,124(16):1783-1791.
[10] Liu AC,Joag VR,Gotlieb AI.The emerging role of valve inter-stitial cell phenotypes in regulating heart valve pathobiology[J].Am J Pathol,2007,171(5):1407-1418.
[11] Bella JN,Tang W,Kraja A,et al.Genome-wide linkage map-ping for valve calcification susceptibility loci in hypertensive sib-ships:the Hypertension Genetic Epidemiology Network Study[J].Hypertension,2007,49(3):453-460.
[12] Ertas FS,Hasan T,Ozdol C,et al.Relationship between angio-tensin-converting enzyme gene polymorphism and severity of aor-tic valve calcification[J].Mayo Clin Proc,2007,82(8):944-950.
[13] Iung B,Vahanian A.Epidemiology of valvular heart disease in the adult[J].Nat Rev Cardiol,2011,8(3):162-172.
[14] Baumgartner H,Hung J,Bermejo J,et al.Echocardiographic assessment of valve stenosis:EAE/ASE recommendations for clinical practice[J].J Am Soc Echocardiogr,2009,22(1):1-23.
[15] Lancellotti P,Moura L,Pierard LA,et al.European Associa-tion of Echocardiography recommendations for the assessment of valvular regurgitation.Part 2:mitral and tricuspid regurgitation(native valve disease)[J].Eur J Echocardiogr,2010,11(4):307-332.
[16] Olsson M,Thyberg J,Nilsson J.Presence of oxidized low densi-ty lipoprotein in nonrheumatic stenotic aortic valves[J].Arterio-scler Thromb Vasc Biol,1999,19(5):1218-1222.
[17] Nishimura RA,Otto CM,Bonow RO,et al.2017 AHA/ACC Focused Update of the 2014 AHA/ACC Guideline for the Man-agement of Patients With Valvular Heart Disease:A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines[J].J Am Coll Cardi-ol,2017,70(2):252-289.
[18] Dweck MR,Boon NA,Newby DE.Calcific aortic stenosis:a disease of the valve and the myocardium[J].J Am Coll Cardi-ol,2012,60(19):1854-1863.
[19] Stewart BF,Siscovick D,Lind BK,et al.Clinical Factors Asso-ciated With Calcific Aortic Valve Disease fn1fn1This study was supported in part by Contracts NO1-HC85079 through HC-850086 from the National Heart,Lung,and Blood Institute,National Institutes of Health,Bethesda,Maryland[J].J Am Coll Cardiol,1997,29(3):630-634.
[20] Capoulade R,Chan KL,Yeang C,et al.Oxidized Phospholip-ids,Lipoprotein(a),and Progression of Calcific Aortic Valve Stenosis[J].J Am Coll Cardiol,2015,66(11):1236-1246.
[21] Clavel MA,Pibarot P,Messika-Zeitoun D,et al.Impact of Aor-tic Valve Calcification,as Measured by MDCT,on Survival in Patients With Aortic Stenosis[J].J Am Coll Cardiol,2014,64(12):1202-1213.
[22] Hjortnaes J,Shapero K,Goettsch C,et al.Valvular interstitial cells suppress calcification of valvular endothelial cells[J].Ath-erosclerosis,2015,242(1):251-260.
[23] Rajamannan NM,Subramaniam M,Rickard D,et al.Human aortic valve calcification is associated with an osteoblast pheno-type[J].Circulation,2003,107(17):2181-2184.
[24] Pawade TA,Newby DE,Dweck MR.Calcification in Aortic Ste-nosis-The Skeleton Key[J].J Am Coll Cardiol,2015,66(5):561-577.
Bioinformatics Analysis of Potential Susceptible Genes Involved in Aortic Valve Calcification
中图分类号: