

岭南现代临床外科 ›› 2019, Vol. 19 ›› Issue (06): 742-745.DOI: 10.3969/j.issn.1009-976X.2019.06.022
于萌蕾, 彭吉才, 曹亿, 黄都平, 杨涛, 朱颉
YU Menglei, PENG Jicai, CAO Yi, HUANG Duping, YANG Tao, ZHU Jie
摘要:
慢性创面,虽然没有统一的定义,但通常指的是创面4周~3月不愈合,可能或不伴随影响创面愈合的基础疾病。自从1937年有文献报道胰岛素可以促进非糖尿病创面愈合以来[2],胰岛素对慢性创面愈合促进作用研究,已经被广泛的报道[3,4]。封闭负压引流技术(vacuum sealing drainage,VSD)可以促进慢性创面的愈合[5,6],也被越来越多地在各级医院普及应用。鉴于两种方法对慢性创面愈合的促进作用,我们使用VSD联合胰岛素溶液局部治疗慢性创面,研究其对慢性创面愈合的影响。
选取2012年1月至2018年12月我院慢性溃疡患者60例,男32例,女28例,年龄22~76岁,平均年龄50.14±8.33岁,溃疡面积4.15~10.24 cm2,平均溃疡面积7.04±1.67 cm2,按入院顺序分为VSD组(A组)、生理盐水+VSD组(B组)、胰岛素溶液+VSD组(C组),每组20例。对3组病例的性别、年龄、BMI指数、病程、溃疡面积、溃疡深度等数据进行比较,差异均无统计学意义(P>0.05),具有可比性。本研究与入组患者均签署知情同意书,并得到医院医学伦理委员会批准。
纳入标准:①年龄≥18岁;②符合慢性创面诊断标准;③4 cm2<溃疡面积<15 cm2;④患者接受并可以配合VSD治疗,且伤口位置适合VSD放置。排除标准:①合并其他急性并发症②合并严重心、脑、肾等全身系统慢性疾病者;③精神异常等无法配合治疗者;④癌性创面;⑤创面有血管神经肌腱外露的情况。
患者以常规口服抗生素预防及控制感染,VSD治疗前行常规清创手术,清除创面坏死组织,确认无活动性出血及重要血管、神经、肌腱外露。A组患者常规清创后,应用一次性负压引流护创材料(山东威高)覆盖创面后用透明膜密闭,接引流管至中心负压,调节压力值为-125 mmHg,使泡沫敷料收缩塌陷紧贴创面,检查创面无外露,透明膜下无积液且无漏气,吸引管通畅。对患者进行常规VSD宣教。保持持续封闭负压吸引6 d。B、C组操作方法同A组,每日同时将输液管与负压冲洗管连接,注入1 U/10 mL胰岛素充盈泡沫材料,持续作用30分钟,后继续对创面实施负压吸引,每天冲洗2次,治疗6 d。
1.3.1 创面组织病理学观察 分别取治疗6 d后的创面中心肉芽组织0.5 g,放入含10%多聚甲醛的PBS中固定24 h,常规脱水,石蜡包埋切片(片厚4~5μm),进行常规HE染色、Masson染色,显微镜下观察。
1.3.2 创面变化 ①肉芽覆盖率:应用Photoshop CS10.0软件(Adobe公司,美国)分别计算患者清创前及治疗6 d后肉芽覆盖率,计算方法:肉芽覆盖面积/创面总面积×100%[7]。②肉芽组织厚度:使用显微测微仪分别于患者清创前及治疗6 d后测量肉芽组织厚度,并计算新生肉芽组织厚度,计算方法:治疗6 d后的肉芽组织厚度-清创前的肉芽组织厚度[8]。③细菌清除率:分别取患者清创前及治疗6 d后的创面分泌物进行常规细菌培养,计算细菌清除率,计算方法:(清创前的菌属数-治疗6 d后的菌属数)/清创前的菌属数×100%[9]。
1.3.3 引流液中成纤维细胞生长因子-2(FGF2)、肿瘤坏死因子α(TNF-α)、α-SMA的含量变化,治疗后每日在同一时间点取引流液,常规称重后用0.01 mol/L的PBS(pH7.4)作为介质进行匀浆,于4℃离心15 min(离心半径13.5 cm、3 000 r/min)。小心取上清液,按放射免疫分析法检测组织匀浆中FGF-2、TNF-α和α-SMA含量。
使用SPSS 22.0统计软件行统计学分析。计量资料以均数±标准差表示,组间及组内比较先行球形检验,采用重复测量方差分析;计数资料行卡方检验分析;检验水准α=0.05。
与A组相比,治疗后6 d B、C组的肉芽覆盖率、肉芽组织厚度及细菌清除率均显著增加,且C组上述指标高于B组,差异均有统计学意义(P <0.05),见表1。
HE染色示:A组肉芽新生毛细血管较少,可见少量成纤维细胞;B组肉芽新生毛细血管较多,可见较多的成纤维细胞增生,伴炎性细胞浸润;C组肉芽见大量新生薄壁毛细血管,成纤维细胞数量多,毛细血管周围可见较多新生成纤维细胞,伴有少量炎性细胞浸润;见图1。Masson染色示:A组蓝染的新生胶原纤维较少;B组可见增生的胶原纤维;C组大量新生胶原纤维(图2)。
表1 三组患者治疗6 d后溃疡创面变化比较(n=20)
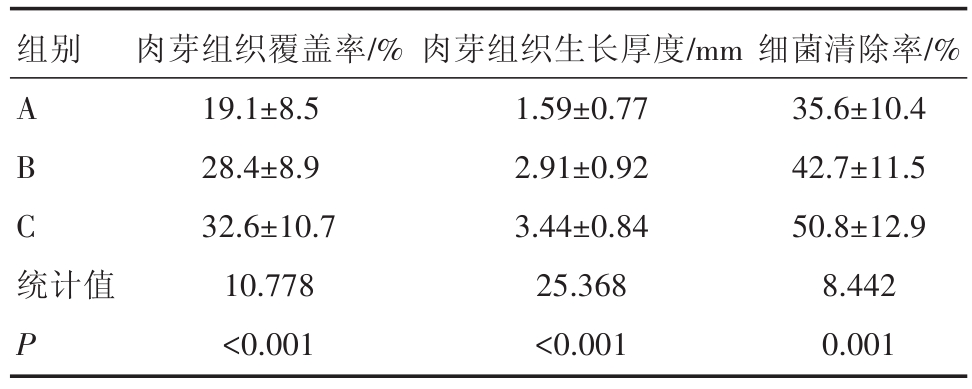
注:*与A组比较,P<0.05,#与B组比较,P<0.05
组别A B C统计值P肉芽组织覆盖率/%19.1±8.5 28.4±8.9 32.6±10.7 10.778<0.001肉芽组织生长厚度/mm 1.59±0.77 2.91±0.92 3.44±0.84 25.368<0.001细菌清除率/%35.6±10.4 42.7±11.5 50.8±12.9 8.442 0.001
组间比较:三组不同处理组治疗后1~6 d,与A组的相同时间点相比,C组引流液中FGF-2、α-SMA含量均显著升高,且TNF-α含量显著低于A组,差异均有统计学意义(P<0.05);与A组的相同时间点相比,B组引流液中FGF-2、α-SMA含量分别于治疗1~6 d及3~6 d时显著升高,TNF-α含量于治疗3~6 d显著低于A组,差异均有统计学意义(P<0.05);与B组的相同时间点比较,C组引流液中FGF-2、α-SMA含量分别于1~6 d及2~6 d升高,TNF-α含量于3~6 d显著下降,差异均有统计学意义(P<0.05)。组内比较:与治疗1 d比较,A、B、C三组引流液中FGF-2、α-SMA含量均从治疗后2 d开始升高直至6 d,TNF-α含量均从治疗2 d开始降低,直至6 d,组内比较差异无统计学意义(P>0.05),见图3。
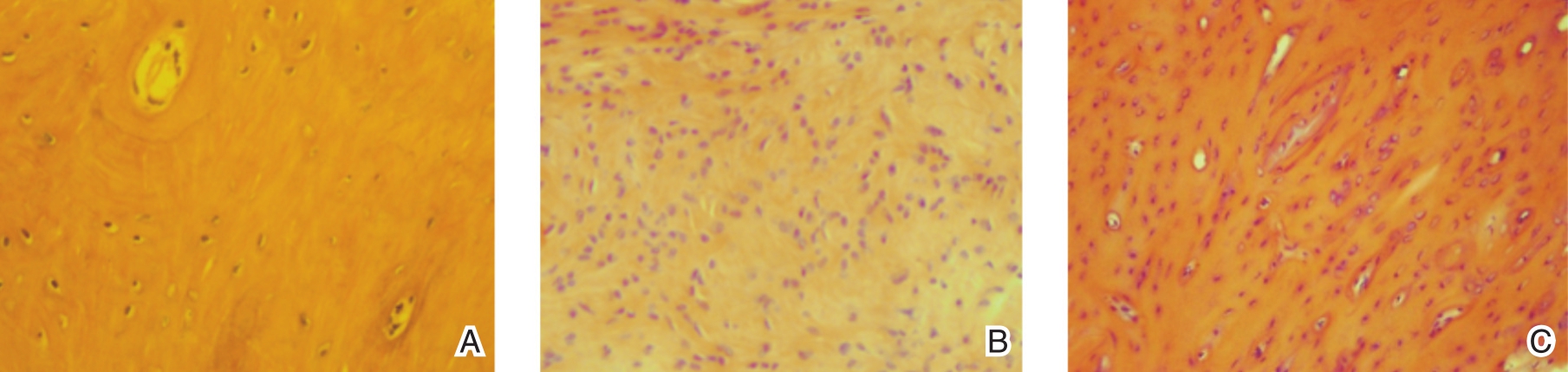
图1 HE染色(×200) A.新生血管和成纤维细胞少;B.新生血管和成纤维细胞较多;C.新生血管和成纤维细胞明显增生
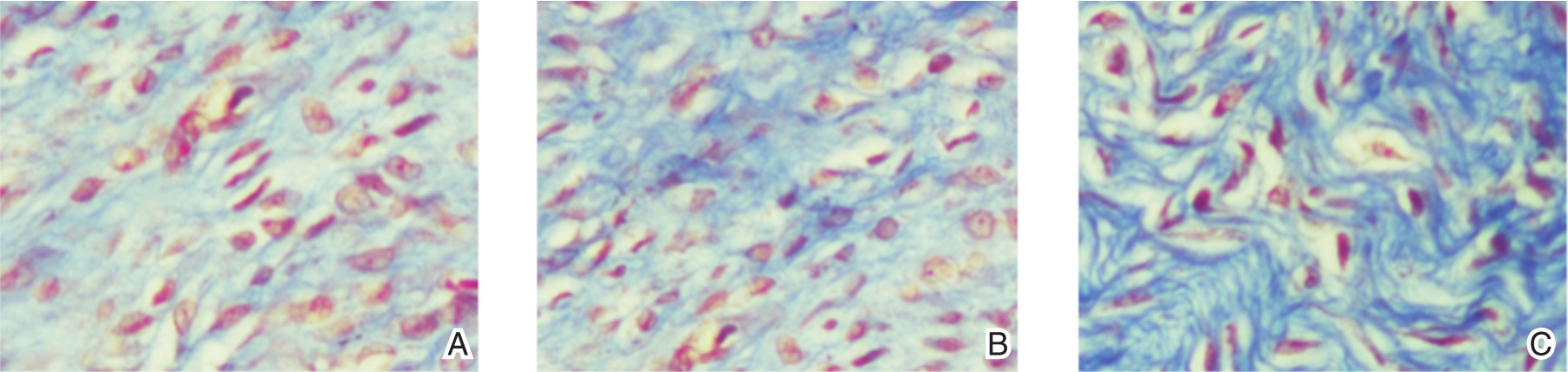
图2 Masson染色(×400) A.新生胶原纤维(蓝染)较少;B.新生胶原纤维(蓝染较多);C.明显增多的新生胶原纤维(蓝染)
伤口愈合是细胞和介质之间一系列复杂反应和相互作用的结果[10]。上皮化、血管生成、肉芽组织形成和胶原沉积是伤口愈合过程中的主要步骤。血管生成是愈合增殖期的一个显著特征,因为受损组织的血流恢复提供了支持修复细胞生长和功能所需的氧气和营养[11]。
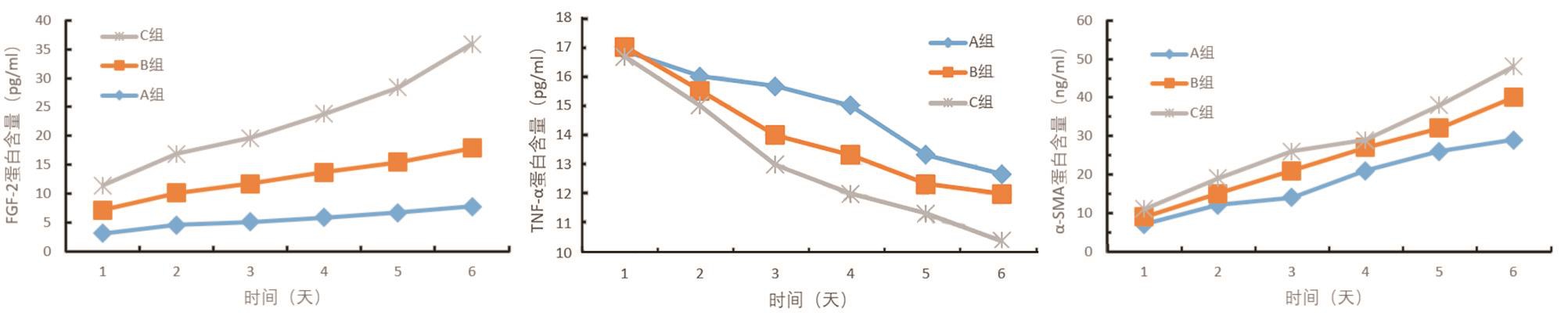
图3 引流组织中IGF-1、TNF-α、α-SMA含量变化
几十年来,胰岛素除了作为葡萄糖、脂肪和蛋白质代谢的调节因子外,还因其对伤口愈合的临床益处而被公认[12]。然而,这些益处只存在于实验动物和糖尿病患者的伤口上。胰岛素是一种肽类激素和生长因子,具有多种生理作用,可能有助于恢复受损皮肤的完整性。因此,针对胰岛素对伤口愈合的研究具有广泛性[13-15]。
研究已证实创面应用胰岛素通过刺激血管生成,加速再上皮化。Apikoglu-Rabus等[16]人报道,对皮肤伤口注射胰岛素可加速有或无急性糖尿病大鼠的伤口愈合。有人认为,伤口愈合过程的改变甚至在糖尿病发病时就开始发生,除了胶原生成显著减少外,还可能与参与正常伤口愈合的防御细胞缺陷有关。胰岛素诱导生长因子的表达,如血管内皮生长因子(VEGF)和胰岛素样生长因子1(IGF-1)[16]。VEGF 是最有效的血管生成因子,VEGF作用下促进真皮下内皮细胞增殖和形成毛细血管[10]。血小板释放IGF-1(一种有效的内皮细胞趋化剂),促进新生血管的形成。血管的建立增加了对受损组织的血流量,从而为新合成的肉芽组织提供胶原沉积和伤口上皮化所需的氧气和营养。
已有研究联合使用VSD和胰岛素溶液治疗糖尿病下肢的慢性溃疡创面并获得良好的效果[17]。我们在本研究中,使用持续封闭负压引流技术联合间断局部使用胰岛素溶液来治疗慢性创面,与对照组单纯使用VSD治疗相比,治疗组明显促进了伤口愈合,促进了局部成纤维细胞的增殖、肉芽形成和促伤口愈合因子的分泌。因此,作者认为,VSD联合局部使用胰岛素是一种有效加速慢性创面愈合的方法,为延迟愈合不愈合的慢性创面治疗提供了有效方法。
[1] Izadi K,Ganchi P.Chronic wounds[J].Clin Plast Surg,2005,32(2):209-222.
[2] Gurd,FB.Postoperative use of insulin in the nondiabetic:with special reference to wound healing[J].Ann Surg,1937,106(4),761-769.
[3] Duluc D,Corvaisier M,Blanchard S,et al.Interferon-gamma reverses the immunosuppressive and protumoral properties and prevents the generation of human tumor-associated macrophages[J].Int JCancer,2009,125(2):367-373.
[4] 杨沛瑯,章雄,刘琰.胰岛素促进创面愈合机制研究进展[J].中华烧伤杂志,2014,4(30):356-359.
[5] Vig S,Dowsett C,Berg L,et al.Evidence-based recommendations for the use of negative pressure wound therapy in chronic wounds:steps towards an international consensus[J].J Tissue Viability 2011,20 Suppl 1,S1-18.
[6] Lo Torto F,Ruggiero M,Parisi P,et al.The effectiveness of negative pressure therapy on infected wounds:preliminary results[J].Int Wound J,2017,14(6):909-914.
[7] 李栋梁,李庆霞,彭代智.数码照相结合Photoshop软件测量平面创面面积[J].中华烧伤杂志,2010,26(1):48.
[8] 孙剑伟.真空辅助闭合技术修复糖尿病足溃疡:随机分组、两阶段交叉设计的方差分析[J].中国组织工程研究与临床康复,2007,11(44):8908-8911.
[9] 陈楚芬,谢肖霞,李爱利,等.负压创面疗法联合冲洗在糖尿病足溃疡治疗中的疗效研究[J].中华损伤与修复杂志(电子版),2012,6(7):674-676.
[10]Broughton G 2nd,Janis JE,Attinger CE.The basic science of wound healing[J].Plast Reconstr Surg,2006,117(7 Suppl):12S-34S.
[11]Broughton G,Janis JE,Attinger CE.Wound healing:an overview.Plast Recontr Surg.2006;117(suppl 7):1-32.
[12]Rosenthal SP.Acceleration of primary wound healing by insulin[J].Arch Surg,1968,96(1):53-55.
[13]Magkos F,Wang X,Mittendorfer B.Metabolic actions of insulin in men and women[J].Nutrition,2010,26(7-8):686-693.
[14]Pierre EJ,Barrow RE,Hawkins HK,et al.Effects of insulin on wound healing[J].JTrauma,1998,44(2):342-345.
[15] Hrynyk M,Neufeld RJ.Insulin and wound healing[J].Burns,2014,40(8):1433-1446.
[16]Apikoglu-Rabus S,Izzettin FV,Turan P,Ercan F.Effect of topical insulin on cutaneous wound healing in rats with or without acute diabetes[J].Clin Exp Dermatol,2009,35(2):180-185.
[17]孙勇,范薇,杨卫玺,等.胰岛素溶液间断冲洗联合封闭式负压持续引流治疗糖尿病下肢慢性溃疡创面的疗效观察[J].中国修复重建外科杂志,2015,29(7):812-817.
Effects of irrigation of insulin solution combined with VSD in chronic wounds
中图分类号: